1. Диаграмма изображенная на чертеже называется – диаграмма
состояния для случая образования компонентами химического соединения. Данная диаграмма характерна для сплавов компоненты которых имеют неограниченную растворимость в жидком состоянии, а в твердом вступают в химическую реакцию образуя новое вещество – химическое соединение.
Определим фазы в различных областях диаграммы, для чего установим на диаграмме: линию ликвидус (ABCDEYWQ), характеризующую температуры начала процесса кристаллизации, выше которых сплавы находятся в жидком состоянии; линию солидус (APBMODGNKMWL), соответствующую температурам, ниже которых сплавы находятся в твердом состоянии.
Между линиями ликвидус и солидус одной фазой является жидкость (Ж), а другой фазой - образующиеся из нее кристаллы
твердой фазы, природу которой следует установить. При этом важно помнить, что могут быть в принципе различающиеся три типа твердых фаз: чистые компоненты (вещества, которые образуют сплавы), химические соединения и твердые растворы. Из них две первые имеют постоянный состав, твердые растворы — переменный.
Пользуясь правилом отрезков определяем состав твердой фазы в областях АРВ и СМВ. Из данного правила следует, что состав твердой фазы при температуре в точке а соответствует проекции точки т на ось концентраций и данным компонентом является Cu. Состав твердой фазы в области СМВ определяем аналогично, проектируя соответствующую точку на ось концентраций. Таким образом твердая фаза в области СМВ – PrCu4.
Состав жидкой фазы в области АРВ по мере понижения температуры изменяется по проекции линии ликвидус АВ , в области СМВ - по проекции линии ликвидус СВ.
Состав твердой фазы в остальных областях находим аналогично, а также определяем изменение состава жидкой фазы.
Ниже линии солидус находятся в качестве фаз лишь твердые кристаллы.
Превращение, при котором кристаллизация двух фаз происходит при постоянной температуре называется эвтектическим, а образующаяся структура эвтектикой. Схема такого превращения следующая:
Ж --- Э(А+В).
2. Рассмотрим кривую охлаждения.
До точки 1, показывающей температуру начала кристаллизации, компоненты находятся в жидком состоянии(Ж).
На участке кривой, находящимся между точками 1 и 2 происходит кристаллизация с выделениями первых кристаллов компонента Си.
Отрезок 2-2’ кривой охлаждения показывает, что процесс кристаллизации осуществляется при постоянной температуре, а образовавшимся компонентом является эвтектика (мелкая дисперсная механическая смесь определенного химического состава). На диаграмме – эвтектикой называется сплав соответствующий точке В. Сплавы расположенные до точки В называются доэвтектическими, а ниже точки В заэвтектическими. Дальнейшее понижение температуры от точки 2’ сопровождается понижением концентрации фазы Си. Окончательная структура сплава состоит Си + Э(Си + PrCu4).
Рассмотрим кривую нагревания.
До температуры отмеченной точкой 1 все компоненты находятся в жидком состоянии(Ж). В интервале температур, обозначенном точками 1-2, из жидкого сплава выделяются первые кристаллы твердой фазы компонента Pr.
На отрезке кривой 2-2’ происходят эвтектические превращения, в результате чего образуется мелкая дисперстная механическая смесь Э(PrCu+Pr).
Ниже температуры точки 2’ концентрация фазы Prпонижается и образуется окончательная структура Pr + Э (PrCu+Pr).
Подтвердить правильность построения графиков можно при помощи правила Гиббса:
С=К+1-Ф
С – степень свободы, определяется числом независимых переменных, которые можно изменить в определенных пределах не нарушая равновесие системы.
К – количество компонентов.
Ф – число фаз.
Для кривой охлаждения число степеней свободы равно:
С1=2+1-2=1;
Степень свободы равная единице говорит о том, что процессы происходят при переменной температуре, на графике будет перегиб.
С2=1+1-2=0;
Степень свободы равна 0, следовательно процессы происходят при постоянной температуре (эвтектические превращения).
Для кривой нагревания число степеней свободы равно:
С1=2+1-2=1(перегиб)
С2=1+1-2=0 (t = const).
3. Пользуясь правилом отрезков можно определить количественное
соотношение и химический состав фаз.
Для того, чтобы определить концентрацию компонентов в
фазах области АВР выберем точку а и проведем через нее горизонтальную линию до пересечения с линиями ограничивающими данную область. Проекции точек пересечения на ось концентраций указывает на состав фаз??????????
Определяем количественное соотношение фаз:
а) Проводим изотерму через данную точку сплава до пересечения с линиями ограничивающими сплав.
б) Находим значение отрезков на которые линия сплава делит изотерму. Зная данные отрезки можно найти соотношение между жидкой и твердой частями сплава:
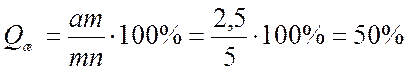
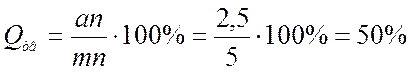
Согласно правилу Курнакова для случая, когда диаграмма состояния соответствует образованию химического соединения, свойства сплавов с изменением состава изменяются по закону прямой линии (аддитивно).
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.