Федеральное агентство по образованию Российской Федерации
Санкт-Петербургский государственный горный институт
им. Г.В. Плеханова (технический университет)
Выполнила студентка группы ОП-04:
Проверила: доцент
Санкт-Петербург
2007
Исследование ионообменной адсорбции.
1. Общие сведения.
Адсорбцией называется самопроизвольный процесс изменения концентрации (парциального давления) на границе раздела двух фаз.
Адсорбент – тело, на поверхности которого протекает адсорбция.
Адсорбат – поглощаемое вещество.
Ионообменная адсорбция происходит избирательно, что приводит к образованию на границе раздела двух фаз двойного электрического слоя, который состоит из адсорбированных ионов и связанных с ними электростатическими силами противоионов. Последние являются подвижными и обмениваются на ионы того же знака.
Ионный обмен
характерен для природных адсорбентов и синтетических ионитов, которые состоят
из твёрдого каркаса (матрицы) с внедрёнными в него функциональными группами.
Если матрица отрицательна, а обмениваются катионы, то адсорбент называют
катионитом. Если матрица заряжена положительно, а противоионы отрицательно, то
такой адсорбент называют анионитом. Ионообменные материалы со смешанными
функциональными группами называют амфолитами. Также иониты делятся по природе
каркаса на неорганические, органические и минерально-органические. Примеры
природных ионитов – это цеолиты, целлюлоза, древесина, торф; искусственных –
селикагели, ![]() , сульфоуголь и наиболее
важные – ионообменные смолы. Применяются для очистки, разделения и
концентрирования веществ из водных, органических и газообразных сред, например,
для очистки сточных вод, сахара, выделения ценных металлов.
, сульфоуголь и наиболее
важные – ионообменные смолы. Применяются для очистки, разделения и
концентрирования веществ из водных, органических и газообразных сред, например,
для очистки сточных вод, сахара, выделения ценных металлов.
Ионный обмен на границе раздела фаз «ионит – раствор» описывают стехиометрическими уравнениями:
1) Для катионита в водородной форме:
![]() ;
;
2) Для анионита в гидроксильной форме:
![]() ;
;
3) Для обратимого
обмена ионов ![]() и
и ![]() между адсорбентом и
раствором в общем виде:
между адсорбентом и
раствором в общем виде:
![]() , где
, где ![]() и
и ![]() – ионы, адсорбированные
ионитом.
– ионы, адсорбированные
ионитом.
Константа ионного обмена, которая характеризует избирательную способность ионита:
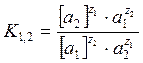 , где
, где ![]() - термодинамическая
активность обменивающихся ионов в ионите и растворе.
- термодинамическая
активность обменивающихся ионов в ионите и растворе.
Уравнение Никольского для поливалентных ионов:
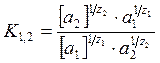 .
.
В практике активности ионов заменяют на их концентрации в растворе.
Иониты характеризует также обменная ёмкость, которая показывает количество ионов, поглощённых единицей массы воздушно – сухого сорбента, выраженное в мг-экв. Она зависит от природы ионита, концентрации обменивающихся ионов и от pH среды.
Обменная ёмкость делится на полную ёмкость (ПОЕ) и обменную ёмкость до проскока (ДОЕ).
ПОЕ характеризует общую поглотительную способность ионита до насыщения.
ДОЕ характеризует количество обменивающихся ионов до первого появления сорбируемых из раствора ионов в фильтрате. ПОЕ всегда будет больше, чем ДОЕ.
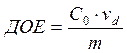
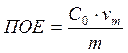 , где m – масса сухого ионита,
, где m – масса сухого ионита,
![]() - исходная концентрация
сорбируемого иона в растворе,
- исходная концентрация
сорбируемого иона в растворе,
![]() - объём раствора,
соответствующий чистому фильтрату (до проскока),
- объём раствора,
соответствующий чистому фильтрату (до проскока),
![]() - объём раствора, который
соответствует половине исходной концентрации. Определяется графическим методом.
- объём раствора, который
соответствует половине исходной концентрации. Определяется графическим методом.
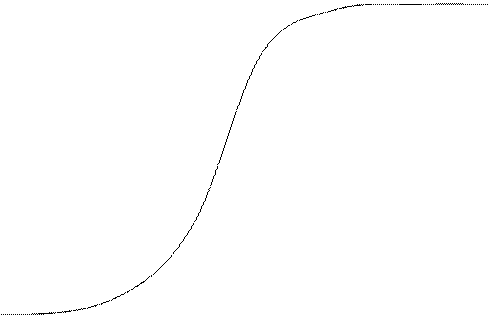
Обменная ёмкость определяется по выходной кривой:
![]() С,
С,
![]()
![]() (г-экв)/л
(г-экв)/л ![]()
![]()
![]()
![]()
![]()
![]() v, мл
v, мл
2. Оборудование и реактивы:
2) раствор соли кобальта;
3) 1 н раствор ![]() ;
;
4) мурексид;
5) катионит;
6) колбы, пипетки и т. д.
3. Методика трилонометрического анализа растворов никеля.
4. Порядок выполнения работы.
1. Готовим адсорбционную колонку. Для этого заполняем её до половины водой, затем медленно высыпаем 10 грамм катионита в водородной форме для его набухания. Через 15 минут воду сливаем.
2. Производим анализ раствора соли кобальта:
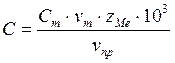 ,
,
где ![]() - концентрация
раствора трилона Б,
- концентрация
раствора трилона Б, ![]() ;
;
![]() -
эквивалентный объём раствора трилона Б;
-
эквивалентный объём раствора трилона Б;
![]() - объём
пробы раствора;
- объём
пробы раствора;
![]() - число
г-экв в одном моле.
- число
г-экв в одном моле.
3. Пропускаем раствор соли через ионит со скоростью 3 – 4 мл в минуту. Фильтрат собираем порциями по 10 мл. Каждую из них анализируем на содержание кобальта. Раствор пропускаем через колонку до тех пор, пока концентрация ионов кобальта на выходе из неё не станет равной исходной.
5. Результаты опыта.
Исправления
|
Номер пробы |
Объём пробы, мл |
Эквивлентн. Объем, мл |
Концентрация ионов металла |
Суммарный объём ф-та. |
|
1 |
10 |
0,2 |
2 |
10 |
|
2 |
10 |
0,4 |
4 |
20 |
|
3 |
10 |
0,6 |
6 |
30 |
|
4 |
10 |
0,6 |
6 |
40 |
|
5 |
10 |
0,6 |
6 |
50 |
|
6 |
10 |
1,0 |
10 |
60 |
|
7 |
10 |
1,6 |
16 |
70 |
|
8 |
10 |
1,7 |
17 |
80 |
|
9 |
10 |
3,0 |
30 |
90 |
|
10 |
10 |
4,2 |
42 |
100 |
|
11 |
10 |
6,2 |
62 |
110 |
|
12 |
10 |
7,3 |
73 |
120 |
|
13 |
10 |
7,6 |
76 |
130 |
|
14 |
10 |
8,2 |
82 |
140 |
|
15 |
10 |
8,8 |
88 |
150 |
|
16 |
10 |
9,2 |
92 |
160 |
|
17 |
10 |
9,5 |
95 |
170 |
|
18 |
10 |
9,6 |
96 |
180 |
|
19 |
10 |
9,7 |
97 |
190 |
|
20 |
10 |
9,8 |
98 |
200 |
|
21 |
10 |
9,8 |
98 |
210 |
6. Расчёт концентрации ионов.
z =2 г-экв,
![]() =10 мл,
=10 мл,
![]() =0,049
=0,049 ![]() ,
,
![]() =0,05
=0,05 ![]() .
.
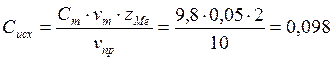
![]() ;
;
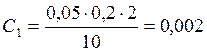
![]() ;
;
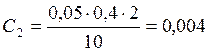
![]() ;
;
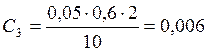
![]() ;
;
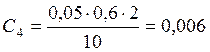
![]() ;
;
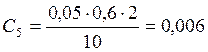
![]() ;
;
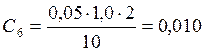
![]() ;
;
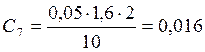
![]() ;
;
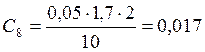
![]() ;
;
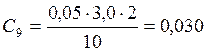
![]() ;
;
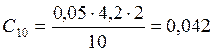
![]() ;
;
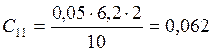
![]() ;
;
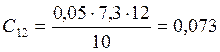
![]() ;
;
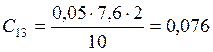
![]() ;
;
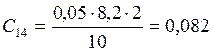
![]() ;
;
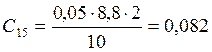
![]() ;
;
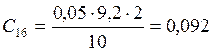
![]() ;
;
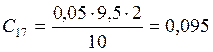
![]() ;
;
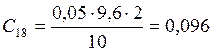
![]() ;
;
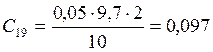
![]() ;
;
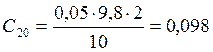
![]() ;
;
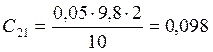
![]() ;
;
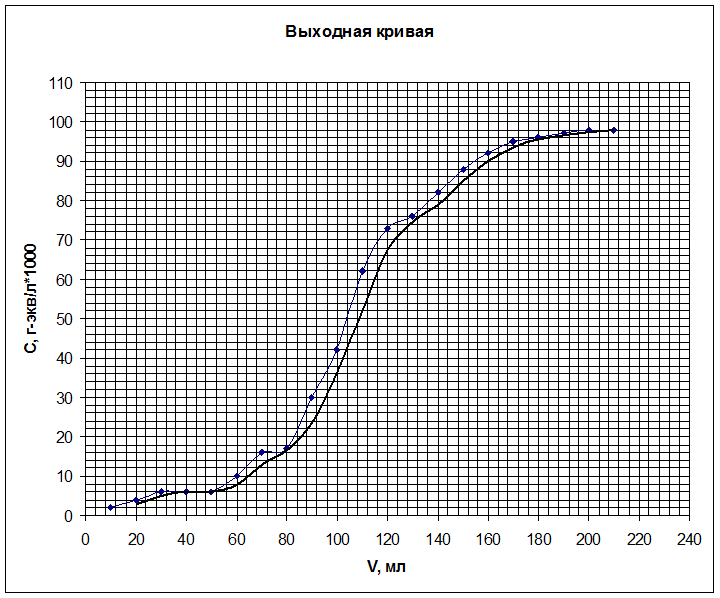
6. Строим выходную кривую ионообменной адсорбции. По
ней определяем объём раствора до проскока ![]() (до
того момента, когда колонка начнёт пропускать ионы кобальта в фильтрат) и объём
раствора, соответствующий половине исходной концентрации
(до
того момента, когда колонка начнёт пропускать ионы кобальта в фильтрат) и объём
раствора, соответствующий половине исходной концентрации ![]() , а затем рассчитываем
ёмкости ПОЕ и ДОЕ.
, а затем рассчитываем
ёмкости ПОЕ и ДОЕ.
![]()
![]()
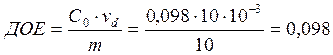 мг-экв/ г
мг-экв/ г
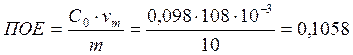 мг-экв/ г
мг-экв/ г
![]() 7. Выводы: ДОЕ - динамическая объемная емкость до
проскока. ПОЕ – полная динамическая объемная емкость ионита. ПОЕ всегда больше
ДОЕ, т.к. ПОЕ характеризует общую адсорбционную способность ионита, а ДОЕ
определяет его технологические возможности. Как видно из результатов
ПОЕ>ДОЕ.
7. Выводы: ДОЕ - динамическая объемная емкость до
проскока. ПОЕ – полная динамическая объемная емкость ионита. ПОЕ всегда больше
ДОЕ, т.к. ПОЕ характеризует общую адсорбционную способность ионита, а ДОЕ
определяет его технологические возможности. Как видно из результатов
ПОЕ>ДОЕ.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.