
















Оглавление
Введение............................................................................................... 3
1 Производство аммиачной селитры.................................................. 4
1.1 Свойства нитрата аммония........................................................ 4
1.2 Физико-химические основы процесса синтеза......................... 4
1.2.1 Нейтрализация.................................................................. 4
1.2.2 Упаривание раствора нитрата аммония.......................... 4
2.1 Технологические схемы производства...................................... 5
1.2.1 Технологическая схема производства нитрата аммония с упариванием.................................................................. 6
1.2.2 Технологическая схема безупарочного метода............... 7
2 Производство карбамида................................................................. 8
2.1 Свойства карбамида................................................................... 8
2.2 Физико-химические основы процесса синтеза......................... 9
2.3. Технологическая схема производства карбамида.................... 9
2.2.1 Технологическая схема с полным жидкостным рециклом......................................................................... 11
2.2.2 Технологическая схема стриппинг-процесса................ 13
3 Производство аммиачной селитры и карбамида в России........... 15
Заключение......................................................................................... 17
Список литературы............................................................................ 18
Важнейшим видом минеральных удобрений являются азотные: аммиачная селитра, карбамид, сульфат аммония, водные растворы аммиака и др. Растения могут потреблять только связанный азот — в форме нитратов, солей аммония или амидов. Сравнительно небольшие количества связанного азота образуются из атмосферного за счет деятельности почвенных микроорганизмов. Однако современное земледелие уже не может существовать без дополнительного внесения в почву азотных удобрений, полученных в результате промышленного связывания атмосферного азота.
Азотные удобрения отличаются друг от друга по содержанию в них азота, по форме соединений азота (нитратные, аммонийные, амидные), фазовому состоянию (твердые и жидкие), различают также физиологически кислые и физиологически щелочные удобрения.
Аммиачная селитра (нитрат аммония) NН4NО3 — кристаллическое вещество белого цвета, содержащее 35% азота в аммонийной и нитратной формах. Гранулированную аммиачную селитру применяют в больших масштабах перед посевом и для всех видов подкормок. В меньших масштабах ее используют для производства взрывчатых веществ.
Нитрат аммония сильно гигроскопичен и легко поглощает влагу из атмосферы. Это является причиной того, что гранулы удобрения расплываются, теряют свою кристаллическую форму, происходит слеживание удобрений - сыпучий материал превращается в твердую монолитную массу.
Впервые аммиачная селитра была получена Глаубером в 1659 году.
Производство нитрата аммония основано на реакции нейтрализации азотной кислоты газообразным аммиаком с последующим упариванием полученного раствора.
Нейтрализация азотной кислоты аммиаком – это необратимый гетерогенный процесс, протекающий с выделением тепла по уравнению:
![]()
Подогрев компонентов (азотной кислоты и газообразного аммиака) улучшает перемешивание системы, ускоряет процесс нейтрализации и повышает концентрацию раствора нитрата аммония.
В результате нейтрализации образуется водный раствор нитрата аммония. При этом за счет теплового эффекта реакции нейтрализации часть воды испаряется в виде сокового пара. Интенсивность испарения зависит от величины теплового эффекта и температуры процесса. Поэтому концентрация образующегося раствора определяется как концентрацией азотной кислоты, так и температурой.
Для испарения воды и концентрирования раствора нитрата аммония можно использовать как внешнее тепло, подводимое к системе, так и теплоту нейтрализации, выделяющуюся в самом процессе.
В соответствии с принципом использования тепла все существующие варианты технологического процесса производства нитрата аммония делятся на две группы:
а) Без упаривания раствора
1) концентрирование раствора осуществляется за счет теплоты нейтрализации азотной кислоты концентрацией 65%;
2) образуется 96% плав нитрата аммония;
б) С упариванием раствора
1) Концентрирование раствора осуществляется как за счет частичного использования теплоты нейтрализации, так и за счет подводимого извне тепла;
Технологичный процесс производства нитрата аммония состоит из следующих основных стадий: нейтрализация азотной кислоты газообразным аммиаком, выпаривание раствора нитрата аммония, кристаллизации и гранулирования плава, охлаждения, классификации и опудривания готового продукта (рис.1).
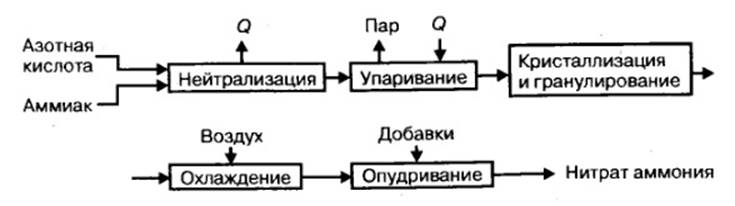
Рисунок 1 – Принципиальная схема производства нитрата аммония [1]
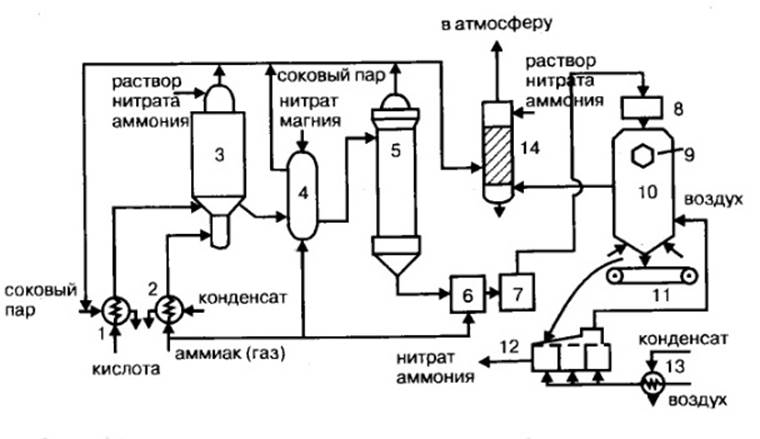
1 – подогреватель аммиака, 2 – подогреватель кислоты, 3 – аппарат ИТН,
4 – донейтрализатор, 5 – выпарной аппарат, 6 – гидрозатвор-донейтрализатор, 7 – сборник плава, 8 – напорный бак, 9 –виброаккустический гранулятор, 10 – грануляционная башня, 11 –транспортер, 12 – охладитель гранул, 13 – подогреватель воздуха, 14 – промывной скруббер
Рисунок 2 – Технологическая схема производства нитрата аммония
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.