вызвать не упругий удар, при котором электроны, передавая атомам ртути практически всю свою энергию, уже не могут преодолеть тормозящего поля, в результате чего ток снижается. При большей энергии электронов соударения вновь делаются упругими и ток возрастает до тех пор, пока энергия электронов не станет кратной энергии неупругого удара.
За счет энергии, полученной от электронов, атомы ртути возбуждаются, т. е. переходят на более высокие энергетические уровни. Как видно из графика, это происходит периодически, когда энергия электрона eе достигает значений, кратных 4,9 эВ. Они соответствуют дозволенным уровням энергии атома ртути, т. е. его стационарным состояниям.
Величина Uз = 4,9 В называется потенциалом возбуждения атомов ртути.
В аналогичных условиях были определены потенциалы возбуждения и других атомов. При некоторой модификации метод позволяет найти также и потенциалы ионизации.
Теория Бора объяснила не только происхождение линейчатых спектров, но и структуру спектра излучения атомов, водорода. В зависимости от энергии, полученной при возбуждении атома, электрон переходит на различные возбужденные уровни. При возвращении его на основной уровень (особенно если этот переход совершается ступенчато) излучаются кванты различной энергии. Поэтому в спектре излучения атома водорода должно быть значительное число линий, расположение которых соответствует энергетическим уровням атома и возможным переходам электрона.
Еще до cоздания теории Бора было уcтановлено, что в спектре водорода имеются группы, или серии, линий, частоты которых, находятся между собой в определенных соотношениях, например, серия Лаймана, Бальмера и др. Экспериментальные формулы для определения частот линий, составляющих ту или иную серию, были объединены в одну общую, называемую ф о р м у л о й Б а л ь м е р а — Р и дб е р га:
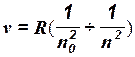
где R== 3,29 · 1015 с-1,n0— постоянное число, характерное для данной серии, a n — число, определяющее каждую из линий; n = nо + 1, nо + 2, nо + 3 и т. д. Например, для серии Лаймана (в ультрафиолетовой части спектра) nо =1; n= 2, 3, 4, ...; для серии Бальмера (в видимой части спектра) nо = 2; n= 3, 4, 5, ...; для серии Пашена (в инфракрасной области) n о= 3; n= 4, 5, 6, ..., и т. д.
|
|
Теория Бора объяснила происхождение этих серий (риc. 17). Энергия излучаемых фотонов равна разности энергетических уровней En и Eno перехода электрона: hv = En — Eno, откудаv = (En —Eno)/h. Подставляя значение энергии уровня из соотношения (3), получаем

где n — квантовое число уровня, от которого переходит электрон, no — квантовое число уровня, на который он переходит. Полученная формула аналогична предыдущей при условии, что постоянная R = me4/(4pħ3). Ее расчетное значение совпадает о экспериментальными данными.
Таким образом, по теории Бора, к серии Лаймана, например, относятся все переходы электронов с возбужденных уровней (n = 2, 3, 4, .,.) на основной (nо = 1), к серии Бальмера — переходы c более высоких
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.