







Дана более подробная, чем обычно, трактовка превращений при высоких давлениях, включая условия геохимических превращений, а также особенностей поведения вещества в высокодиспергированном (наноразмерном) состоянии.
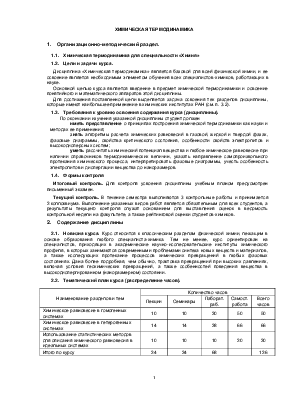
2.2. Тематический план курса (распределение часов).
|
Наименование разделов и тем |
Количество часов |
||||
|
Лекции |
Семинары |
Лаборат. раб. |
Самост. работа |
Всего часов |
|
|
Химическое равновесие в гомогенных системах |
10 |
10 |
30 |
50 |
50 |
|
Химическое равновесие в гетерогенных системах |
14 |
14 |
38 |
66 |
66 |
|
Использование статистических методов для описания химического равновесия в идеальных системах |
10 |
10 |
10 |
30 |
30 |
|
Итого по курсу |
34 |
34 |
68 |
136 |
|
2.3. Содержание отдельных разделов и тем.
1. Основные понятия химической термодинамики
Изолированные, закрытые и открытые системы. Равновесные и неравновесные процессы. Химическая переменная. Интенсивные и экстенсивные свойства. Функция состояния и уравнения состояния. Теплота. Работа. Внутренняя энергия. Энтальпия. Теплоемкости. Первое начало термодинамики. Закон Гесса. Стандартные состояния. Закон Кирхгофа. Энтропия. Второе и третье начала термодинамики. Связь энтропии и термодинамической вероятности состояния. Характеристические функции. Термодинамические потенциалы. Фундаментальные уравнения и термодинамические соотношения между величинами. Химический потенциал. Зависимость химических потенциалов от давления и температуры для идеальных: газа, растворенного вещества, твердого тела.
2. Химические равновесия в идеальных системах
Полезная работа химической реакции. Направление самопроизвольного химического процесса в изолированной и закрытой системах. Условия равновесия закрытой химической системы. Расчет величины химического потенциала. Химическое сродство реакции. Закон действующих масс. Константа равновесия. Уравнение изотермы, изобары и изохоры химической реакции (зависимость констант равновесия от давления и температуры). Направление протекания химических процессов при выводе системы из термодинамического равновесия. Принцип Ле-Шателье. Определение числа линейно-независимых реакций.
3. Химическое равновесие в неидеальных системах
Летучесть (фугитивность). Химический потенциал неидеального газа. Уравнения состояния реальных газов. Химическое равновесие в реальных газах. Активность. Коэффициент активности.
1. Фазовые равновесия в однокомпонентных системах
Фазовые переходы I и II рода. Соотношение Клапейрона–Клаузиуса. Равновесие «пар–жидкость» и «пар–твердая фаза». Равновесие «твердая фаза–твердая фаза». Равновесие «расплав–твердое тело». Критическое состояние вещества. Примеры фазовых равновесий (диаграмм) в однокомпонентных системах. Правила Трутона.
2. Фазовые равновесия в двух- и многокомпонентных системах
Парциальные молярные величины. Условия равновесия в многофазных многокомпонентных системах. Правило фаз Гиббса. Уравнение Гиббса–Дюгема. Функции смешения идеальных и неидеальных смесей: объем, энтропия, энтальпия, энергия Гиббса смешения. Избыточные функции смешения.
3. Растворы. Равновесия «жидкость–пар» и «жидкость–твердое тело»
Классификация растворов: совершенные, регулярные, атермальные. Законы Рауля и Генри. Законы Коновалова. Основные типы диаграмм равновесия «жидкость–пар». Различные типы стандартных состояний химического потенциала в растворах. Предельно разбавленные растворы. Равновесия в растворах нелетучих веществ в летучих растворителях (бинарный раствор–чистый компонент). Уравнение Шредера. Эбуллиоскопия, криоскопия. Осмос. Основные типы диаграмм равновесия двухкомпонентных систем «жидкость–твердое тело». Равновесия в системах с газовыми гидратами. Некоторые представления о фазовых равновесиях в трехкомпонентных системах.
4. Элементы теории растворов электролитов и электрохимии
Сольватация. Электролитическая диссоциация. Элементы теории Дебая–Хюккеля. Коэффициенты активности ионов, ионная сила раствора. Окислительно-восстановительные превращения в растворах. Электродные потенциалы. Уравнение Нернста.
5. Дисперсные системы и поверхностные явления
Типы дисперсных систем. Поверхностное натяжение. Термодинамика систем с поверхностью раздела. Термодинамическая устойчивость дисперсных систем. Влияние диспергирования вещества на фазовые равновесия и растворимость вещества. Адсорбция.
ИСПОЛЬЗОВАНИЕ СТАТИСТИЧЕСКИХ МЕТОДОВ ДЛЯ ОПИСАНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ В ИДЕАЛЬНЫХ СИСТЕМАХ
1. Статистическое описание идеальных газофазных систем
Статсумма. Поступательная статсумма. Вращательная статсумма. Внутреннее вращение. Колебательная статсумма. Энергия Гельмгольца. Энтропия. Внутренняя энергия, энтальпия, энергия Гиббса. Теплоемкость. Химический потенциал. Константа равновесия. Выражения для константы равновесия КР. Статистический расчет приближенных значений констант равновесия в реакциях изотопного обмена или изомеризации.
Домашние задания
(Задачи по: Музыкантов В.С. Бажин Н.М., Пармон В.Н., Булгаков Н.Н., Иванченко В.А. Задачи по химической термодинамике. Москва: Химия, 2001)
Задание 1 Сдача задания с 10 по 17 октября
1-7, 1-15, 1-16 (a,б), 1-26, 1-30, 1-31, 1-43, 1-44, 2-3, 2-5, 2-12, 2-39, 3-8, 3-17, 4-4, 4-22, 4-57, 4-78, 5-5, 5-7, 6-24.
· Для диссоциации N2O4 с образованием NO2 при 298 К КР = 0,141. Рассчитать равновесный состав в системе при общем давлении 1 бар: а) при наличии только N2O4 в начальном состоянии; б) добавлении в систему 0,6 бар аргона (система расширяется по мере добавления Ar при постоянном общем давлении 1 бар); в) общем давлении 0,1 бар при наличии только N2O4 в начальном состоянии.
Задание 2 Сдача задания с 20 по 27 ноября
8-2, 8-11, 8-13, 9-3, 9-6, 9-13, 9-17, 9-20, 9-25, 9-27, 10-4, 10-11, 10-20, 10-27, 11-2, 11-10, 11-17, 11-22, 11-49, 11-51.
· Превращение кристаллической модификации углекислого кальция «арагонит» в модификацию «кальцит» при 25 °С сопровождается уменьшением изобарно-изотермического потенциала на 190 кал/моль. При каком давлении при этой же температуре обе формы CaCO3 могут сосуществовать? Известно, что плотность арагонита 2,93, а кальцита – 2,71 г/см3.
Задание 3 Сдача задания с 15 по 20 декабря
7-41, 7-54, 7-56 (O2, CO2, NH3, C2H4, C3H8, Alкр), 7-58, 12-5, 12-10, 12-18, 12-24, 12-28, 12-31, 13-4, 13-9, 13-12, 13-24, 14-7, 14-9, 15-9.
· Рассчитать предельные значения СР (низкие, промежуточные и очень высокие температуры) для Н2, C2H2, C2H4, C2H6.
·· Основное состояние атома кислорода расщепляется на три мультиплета с энергиями 0, 158, 227 см–1. Найти вклад в СР атома кислорода электронной составляющей при Т = 1500 К.
Оценки в баллах для системы Индивидуального Коммулятивного Индекса
Домашние задания: 50(I), 50(II), 50(III)
Сдача заданий: 100(I), 100(II), 50(III)
Контрольные работы: 400(I), 500(II), 400(III)
Результативность по работе в семестре:
«отлично» – 1500, «хорошо» – 1200,
«удовлетворительно» – 1000.
Экзамен: 400.
Примерный план семинаров
Семинары 1–3. Основные понятия химической термодинамики:
Химическая переменная. Первое начало. Закон Гесса. Стандартные состояния. Закон Кирхгоффа. Второе и третье начала. Термодинамические потенциалы. Фундаментальные уравнения. Химический потенциал.
Задание: (здесь и далее – по задачнику Музыкантов В.С. и др., НГУ, 1977) 6-1, 6-9, 6-13, 6-20, 5-6, 7-5, 7-6, 7-14, 2-3г, 2-5а,б, 7-14.
Семинары 4–7. Химическое равновесие
Направление самопроизвольного химического процесса. Условия равновесия. Расчет константы равновесия из термодинамических величин образования компонентов. Уравнение изотермы и изобары химической реакции. Расчет равновесного состава. Определение числа линейнонезависимых реакций.
Задание: 12-6, 12-15, 12-14, 12-46, 13-3, 13-7, 12-1, 12-3, 12-4, 13-30б, 12-56, 12-58, 13-32.
Прием задания 1. Контрольная работа 1
Семинар 8. Фазовые равновесия в однокомпонентных системах
Уравнение Клапейрона–Клаузиса. Правило фаз Гиббса.
Задание: 9-3, 9-4, 9-19, 9-27.
Семинары 9–11. Фазовые равновесия в многокомпонентных системах
Парциальные молярные величины. Уравнение Гиббса–Дюгема. Функции смешения, идеальные, неидеальные, избыточные. Растворы, их классификация. Законы Рауля и Генри. Уравнение Шредера. Эбуллиоскопия, криоскопия. Осмос. Основные типы фазовых диаграмм, «правило рычага».
Задание: 11-1, 11-5, 11-10, 11-19, 11-22, 10-7, 10-12, 10-14, 10-22, 10-25, 10-28 и др.; 16-1, 16-12, 16-13, 16-18.
Прием задания 2. Контрольная работа 2
Семинары 12–13. Элементы теории электролитов и электрохимии
Использование уравнения Дебая–Хюккеля. Расчет ЭДС гальванических ячеек и равновесий в случае окислительно-восстановительных реакций.
Расчет фазовых равновесий в дисперсных системах.
Семинары 15–16. Использование статистических методов в химической термодинамики
Расчет химических потенциалов и констант равновесия статистическими методами.
Задание: 1-3, 1-10, 1-21, 3-9, 3-22, 4-9, 4-13, 4-25 (для СО), 5-14, 12-13, 12-10, 12-26а,б.
Прием задания 3. Контрольная работа 3
2.4. Перечень примерных контрольных вопросов и заданий для самостоятельной работы (см. п. 3).
3.2. Темы курсовых работ соответствуют темам научной практики студентов в институтах СО РАН. Например: «Исследование равновесия изомеризации глюкозы в водном
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.