Определение зависимости насыщенного пара от температуры кипения.
Расчет теплоты парообразования.
Выполнили:
29.10.03
Теория
Мольный объем пара V(г)=RT/P. V(г)>>V(ж), соответственно V(г)-V(ж)= V(г)
∆Н(Т)= ∆Н0(Т), тогда уравнение Клаузиуса –Клайперона имеет вид: dP/dT=∆Н(Т)*P/RT2
Так как интервал изменения температуры невелик, то можно пренебречь зависимостью ∆Н от температуры. Для расчёта по нашей кривой приведём уравнение Клаузиуса –Клайперона к виду dlnP/d(1000/T)=-∆Н0/1000*R
∆Sф.п=∆Н0ф.п./Tф.п.
∆E=∆Н0ф.п-P*∆V=∆Н0ф.п-R*T
Оцениваем энергию межмолекулярного взаимодействия в жидкости между соседними молекулами:
e=2 E/z ,z=10
Экспериментальная часть.
Провели эксперимент и занесли результаты в таблицу:
|
h (лев.) |
h (прав.) |
P aтм. |
T (кип.) |
T, К |
Dh |
P |
1000/T |
Lg P |
|
535 |
504 |
763 |
78,2 |
351,35 |
520 |
244 |
2,846 |
2,39 |
|
479 |
455 |
763 |
82,8 |
355,95 |
467 |
296 |
2,809 |
2,47 |
|
438 |
417 |
763 |
85,5 |
358,65 |
428 |
336 |
2,790 |
2,53 |
|
392 |
376 |
763 |
88,5 |
361,65 |
384 |
379 |
2,765 |
2,58 |
|
354 |
340 |
763 |
91 |
364,15 |
347 |
413 |
2,746 |
2,62 |
|
309 |
299 |
763 |
93 |
366,15 |
304 |
459 |
2,731 |
2,66 |
|
270 |
259 |
763 |
95,1 |
368,25 |
265 |
499 |
2,716 |
2,70 |
|
220 |
215 |
763 |
97,3 |
370,45 |
218 |
545 |
2,700 |
2,74 |
|
178 |
179 |
763 |
99,4 |
372,55 |
178,5 |
584,5 |
2,684 |
2,77 |
|
120 |
124 |
763 |
101,5 |
374,65 |
122 |
641 |
2,670 |
2,8 |
|
74 |
84 |
763 |
103,6 |
376,55 |
79 |
684 |
2,654 |
2,84 |
|
25 |
40 |
763 |
105,1 |
378,25 |
32,5 |
730,5 |
2,643 |
2,86 |
|
8 |
10 |
763 |
106,4 |
379,55 |
9 |
754 |
2,635 |
2,87 |
где h (лев.) и h (прав.) показания U – образной трубки
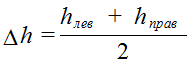
![]()
Строим график зависимости lgP от 1000/T: 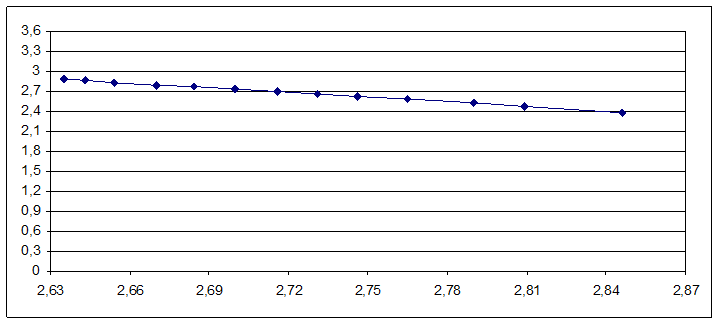
По графику определяем нормальную температуру кипения изобутилового спирта:
Тэксп. = 107оС(380К)
Сравниваем ее с табличной величиной: Тсправ. = 108оС
∆Н0ф.п=18кДж/моль
∆Sф.п=47.4 Дж/моль*К
∆E=18000-8.31*380=14842 Дж/моль
S2980(г)=S2980(ж)+Cp(ж)lg(380/298)+∆Sф.п0-Cp(г)lg(298/380)
е=2968.4 Дж/моль=3кДж/моль
Энергия химической связи в среднем равняется 200-400 кДж/моль. Следовательно энергия взаимодействия молекул в жидкости в 100 раз меньше энергии химической связи.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.