Давление NO: P(NO)=Р0(NO)*(1-ξ)=Р0(NO)*(1-D/Dmax)
Вычисление порядка реакции. Будем считать , что кинетическое уравнение имеет вид:
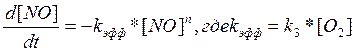
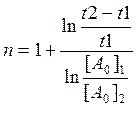
При условии , что за времена t2-t1 и t1 глубина реакции ( ξ ) одинаковая
[A0]2=[A0]1*(1-ξ)
Рассчитаем несколько n:
Пусть [P0]1=110 и 1-ξ=0,615 тогда [P0]2=67,6 и [Pкон]=41,6 это соответствует времени t2=22,5 с (из графика ) по формуле получаем n=0,724
Пусть 1-ξ=0,464 [P0]2=51,1 и [Pкон]=23,7 это соответствует времени t2=39 с (из графика ) по формуле получаем n=1,2
Этот метод не даёт никаких результатов.
По экспериментальным данным построим график в спрямляющих координатах.
Предположим , что n=2 тогда имеем уравнение
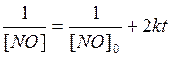
100мм.рт.ст. 70мм.рт.ст.
|
t |
1/P(NO) |
t |
1/P(NO) |
|
0 |
0,00909 |
0,00 |
0,019421 |
|
6,0 |
0,01097 |
2,00 |
0,019879 |
|
12,0 |
0,01479 |
4,00 |
0,020458 |
|
18 |
0,01959 |
6,00 |
0,020967 |
|
24,0 |
0,02521 |
8,00 |
0,021501 |
|
30,0 |
0,03169 |
10,00 |
0,022064 |
|
36 |
0,03926 |
12,00 |
0,022536 |
|
42,0 |
0,04720 |
14,00 |
0,022904 |
|
48,0 |
0,05616 |
16,00 |
0,023413 |
|
54 |
0,06524 |
18,00 |
0,023945 |
|
60,0 |
0,07456 |
0,00 |
0,019421 |
|
|
|
Полученная прямая соответствует кинетическому уравнению второго порядка (1/Р0=0,016, а 1/P0 истинная равна 0,00909), (1/Р0=0.0194, а1/P0 истинная равна 0,0194). Таким образом порядок реакции равен 2,
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.