Определим молярную долю NiF2 в системе:
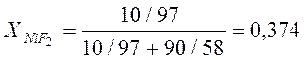 ;
;
Тогда теплота плавления NiF2:
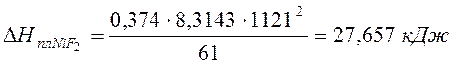
Температура начала кристаллизации системы, содержащей 50% KF
Т1=1403К.
Температура
плавления NiF2 ![]() =1121 К.
=1121 К.
Понижение
температуры кристаллизации ![]() =1403-1121=282 К.
=1403-1121=282 К.
Определим молярную долю KF в системе:
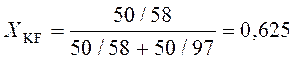 ;
;
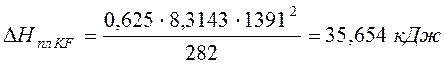 .
.
Теплоты плавления веществ можно вычислить по формуле числа Лоренца:
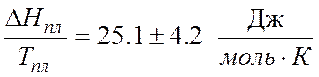
где ![]() –
теплота плавления;
–
теплота плавления;
Тпл – температура плавления чистого вещества.
Чистые компоненты соответствуют крайним точкам кривой ликвидуса на
диаграмме. Выражая из формулы ![]() получаем:
получаем:
![]() ( NiF2) = Тпл
(NiF2) ∙ 25,1 = 1121 ∙ 25,1 = 28137,1 Дж/моль;
( NiF2) = Тпл
(NiF2) ∙ 25,1 = 1121 ∙ 25,1 = 28137,1 Дж/моль;
![]() (KF) = Тпл(KF) ∙ 25,1 = 1391 ∙ 25,1 = 34914,1 Дж/моль.
(KF) = Тпл(KF) ∙ 25,1 = 1391 ∙ 25,1 = 34914,1 Дж/моль.
11.Определение выкристализуещегося компонента и его количества при охлаждения данного плава
При температуре 1273 К фигуративная точка находится выше линии Ликвидуса, следовательно все вещество находится в жидкой фазе и кристаллическая фаза отсутствует, значит масса кристаллов изначально равна нулю. Далее, при охлаждении системы, фигуративная точка опускается вниз и пресекает линию Ликвидуса, начинается выпадение кристаллов АВ, и при температуре 1113 К, система будет состоять из кристаллов вещества АВ и плава, содержащего 15% вещества А.
Соотношение между массами различных фаз определяется при помощи правила рычага.
Пусть ![]() - количество плава
(моль),
- количество плава
(моль),
![]() - количество выпавших кристаллов
(моль),
- количество выпавших кристаллов
(моль),
![]() - количество расплава
(моль),
- количество расплава
(моль),
![]() - количество вещества
А в плаве %,
- количество вещества
А в плаве %,
![]() - количество вещества
А в расплаве %,
- количество вещества
А в расплаве %,
![]() - количество
выкристаллизовавшегося вещества А %,
- количество
выкристаллизовавшегося вещества А %,
Правило рычага можно записать в
виде: 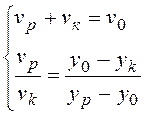 , откуда можно выразить количество моль
кристаллов вещества А:
, откуда можно выразить количество моль
кристаллов вещества А: 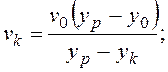
Посчитаем количество моль плава:
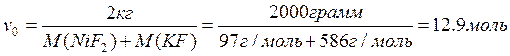
При температуре 1173 К вся система находилась в жидкой фазе следовательно масса кристаллов равна 0.
Рассчитывается количество кристаллов, выпавшая при температуре 973 К
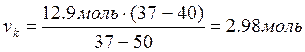 .
.
Тогда масса выпавших кристаллов можно рассчитать:
![]()
Масса кристаллов выпавшая при температуре 1113 К равна массе кристаллов выпавшей при охлаждении от 1273 К до 1113 К и равна 289 грамм.
Кристаллическая решетка KF представленная в приложение 3 представляет собой простую кубическую кристаллическую решетку XII рода. Кристаллическая решетка NiF2 представленная в приложении 3 представляет собой базацентрированную кубическую решетку XIII рода.
В ходе работы были исследованы состояния двухкомпонентной системы. По данным о температуре кристаллизации и составе двухкомпонентной системы была построена диаграмма фазового состояния этой системы, которая имеет одну эвтектику (две скрытые) и две перетектики; состав эвтектики – 9,2 мол.% вещества NiF2 и 90,8 мол.% вещества KF; состав перитектик: в точке С – 21,8 мол.% А и 78,2 мол.%, в точке D – 26 мол.% А и 74 мол.% В. В системе образовалось три химических соединения NiF2·KF (конгруэнтно плавящееся), NiF2·3KF и NiF2·4KF (инконгруэтно плавящиеся). Вычерчены все типы кривых охлаждения возможные в этой системе. Были определены физические состояния системы при разных температурах. По правилу фаз Гиббса было определенно число фаз и число термодинамических степеней свободы системы при температуре 1060 и содержании вещества NiF2 – 5 мол.%. Также были определены температуры отвердения и расплавления сплава при содержании вещества KF 20 мол.%. Были вычислены теплоты плавления веществ NiF2 и KF:
![]() ( NiF2)
( NiF2) ![]() 28000 Дж/моль;
28000 Дж/моль;
![]() (KF)
(KF) ![]() 35000 Дж/моль.
35000 Дж/моль.
В результате охлаждения 2 кг плава от 1273 К до 1113 К выкристаллизовалось вещество NiF2∙KF в количестве 289 грамм.
Список литературы
1. Практические работы по физической химии. /ред. Мищенко К.П., Равделя А.А., Пономаревой А.М. -Л: Химия, 1982.
2. Физичсекая химия в вопросах и ответах. /ред. Топчиевой К.В., Федорович Н.В. -М: из-во МГУ, 1981.
3. Даниэли Ф., Олберти Р. Физическая химия. -М: Мир, 1978, с. 256.
4. Курс физической химии/ Под ред. А.Я. Герасимова. М.: Высш. шк., 1973. Т.2.
5. Киреев В.А. Курс Физической химии :.М. 1975.
6. www.webelements.com
|
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.