6. Какой компонент и в каком количестве может быть выделен из системы, состоящей из 64 кг этанола (А) и 36 кг (В).
Исходная система: – 64 кг (М = 93 г/моль), C6H6 = 36 кг (М = 78 г/моль). Исходные количества вещества
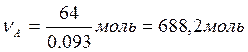 ;
; 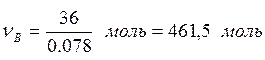 .
.
Мольная доля компонента А
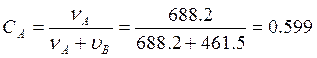 .
.
Таким образом, состав раствора лежит правее точки касания диаграмм. Поэтому раствор такого состава можно разделить на чистый этанол (компонент В) и азеотропный раствор этанола и бензола. Азеотроп имеет состав: C2H6O = 44 мол.%, C6H6 = 56 мол.%, т.е. можно записать
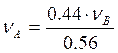 .
.
Количество вещества компонента А, остающегося в составе азеотропа
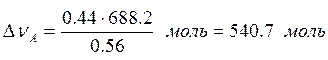 .
.
Если перевести это количество вещества в массу, то получится
![]() .
.
Масса чистого фурфурола, который можно выделить из раствора
![]() .
.
7. Какого компонента и в каком количестве надо добавить к указанной в п.6 смеси, чтобы получился азеотропный раствор.
Азеотропный раствор должен содержать бензола 56 мол.%, поэтому
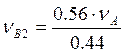 ;
;
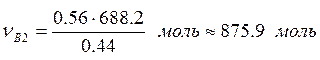 .
.
Но в исходном растворе уже присутствует 461,5 моль вещества В (бензола), поэтому добавить надо всего
![]()
Если перевести это количество вещества в массу, то получится
![]() .
.
Таким образом, к исходному раствору нужно добавить 32.3 кг бензола, чтобы получился азеотропный раствор этанола и бензола.
8. Какое количество вещества А (кг) будет в парах и в растворе, если 2 кг смеси, содержащей 75 % вещества А, нагреть до температуры 345 К.
Т.к. СА=3СВ, то ![]() . Для
массы смеси можно записать
. Для
массы смеси можно записать
![]() , т.к.
, т.к. ![]() , то
, то
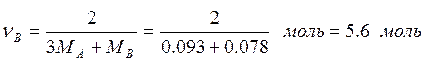 ,
,
![]() .
.
При температуре 345 К жидкость и пар имеют состав: А – 0,876 мол.долей, В – 0,124 мол.долей и А – 0,692 мол.долей, В – 0,308 мол.долей соответственно. Откуда получим:
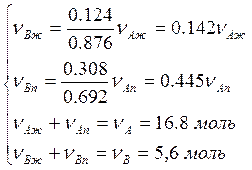 .
.
Подставляя первое, второе и третье уравнения в четвёртое получаем
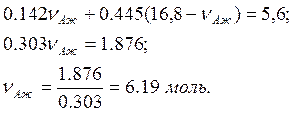 (7)
(7)
![]() , следовательно, равно
, следовательно, равно
![]() .
.
Переход от количества вещества к массе
![]() ,
,
![]() .
.
Таким образом, при температуре 345 К в жидкости будет находится 0,58 кг этанола, а в паре – 1,15 кг.
9. Определить вариантность системы в азеотропной точке.
Вариантность системы определяется по выражению
![]() , где К – число независимых компонентов системы, Ф – число фаз.
, где К – число независимых компонентов системы, Ф – число фаз.
В данном случае система состоит из 2-х компонентов: воды и фурфурола. Фаз в системе четыре: жидкий и парообразный этанол и бензол. Таким образом, вариантность системы равна
![]() , т.е. система
инвариантная.
, т.е. система
инвариантная.
Вывод: В ходе выполнения лабораторной работы были построены две диаграммы: состав пара-состав раствора (рис. 1) и состав-температура кипения (рис. 2). По рис. 2 видно, что графики для пара и жидкости касаются в точке: C2H6O – 44 мол. %, C6H6 – 56 мол. %. В этой точке состав жидкости одинаков с составом пара, и она называется азеотропной точкой. По этой диаграмме можно также определить температуру кипения раствора по его составу и наоборот. При определении состава пара и жидкости по известной температуре кипения выяснилось, что можно приготовить два раствора различного состава, но кипящих при одной температуре.
Вариантность системы также называют числом термодинамических степеней свободы. Она определяет наибольшее число факторов, которые могут изменяться независимо один от другого. Или по-другому, это число условий, которые можно произвольно менять, не изменяя этим числа или вида фаз. Число степеней свободы возрастает с увеличением числа компонентов и уменьшается с увеличением числа фаз в системе. Рассматриваемая в работе система оказалась инвариантной.
Бинарные системы можно разделить дистилляцией на чистые компоненты, причем разделение тем лучше, чем сильнее отличаются состав жидкости и равновесного с ней пара. Рассматриваемую в данной работе систему нельзя разделить на два чистых компонента, а лишь на один из компонентов и азеотропный раствор. Если исходная жидкость имеет состав левее точки касания графиков, то она разделяется на компонент В (бензол) и азеотропный раствор А и В (этанола с бензолом). Если же состав раствора лежит правее точки касания графиков, то он разделим на компонент А (этанол) и опять таки азеотропный раствор.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.