









Химический состав материалов
По химическому составу различают : простые и сложные вещества. Все простые вещества делятся на три группы : металлы (около 80), неметаллы -12 и полуметаллы -13.
В конструкциях электронных средств в элементарном состоянии применяются те металлы , которые проявляют в этом состоянии необходимые свойства , например, электропроводность (серебро , медь , золото, алюминий),высокую коррозионную стойкость (цинк , хром , никель и др.).
Из полуметаллов – Si,Ge (в производстве полупроводниковых изделий), углерод , являющийся основой большинства органических соединений.
Неметаллы – в элементарном виде практически не используются , так как большинство из них газы , бром – жидкость , йод , сера – твёрдые.
Типы химической связи:
В основе всех связей лежит кулоновского взаимодействия между разноимённо заряженными частицами
Ионная химическая связь
Рассмотрим пример KCl. Стремление хлора заполнить восьмую электронную оболочку приводит к тому , что один единственный электрон калия притягивается к иону хлора. Локализация электронов исключает их перемещение по кристаллу , поэтому при нормальных условиях ионные кристаллы – диэлектрики.
Ковалентная связь
В таких кристаллах устойчивая восьмая электронная оболочка , образуется за счёт спаривания электронов двух соседних атомов.
Электронная плотность между узлами решётки довольно велика , появляется возможность перемещения электронов по кристаллу , поэтому ковалентные кристаллы чаще всего – полупроводники. Между ионной и ковалентной связями различают :
АII ВVI ионно – ковалентную связь
АII ВV ковалентно – ионную связь
Металлическая связь
Металлическая связь присуща металлам . У атомов металла валентных электронов мало , они не могут образовать восьми электронную оболочку и поэтому отдают валентные электроны в общее пользование. Свободные электроны обеспечивают высокую электрическую проводимость металлов.
Материалы с металлической связью – проводники. Наличие свободных электронов обуславливает специфические свойства метала.(электропроводность , пластичность , блеск).
Молекулярная связь
Молекулярная связь – это связь за счёт Вандер Ваальса , самая слабая . Вещества с такой связью имеют низкую температуру плавления.
Структура материалов.
Структуру материала характеризуют следующие признаки :
1) Степень упорядоченности расположения микрочастиц.
2) Особенности и характер взаимного расположения.
3) Виды и концентрация дефектов.
4) Состав и строение фаз.
1. Степень упорядоченности расположения микрочастиц.
По степени упорядоченности внутренней структуры материалы подразделяют на кристаллические и аморфные. Для кристаллических характерна трехмерное периодическое пространственное расположение микрочастиц, т.е наличие дальнего порядка. Аморфные материалы дальним порядком не обладают, но ближний порядок просматривается. Примеры аморфных материалов: смолы, многие полимеры, квазиаморфное стекло и т.д.
Кристаллические материалы подразделяют на монокристаллические и поликристаллические.
Монокристалл – это единичный, достаточно крупный кристалл с совершенной структурой, т.е дальний порядок сохраняется практически во всем объеме. На практике используется в полупроводниковой технологии.
Поликристалл – это совокупность неориентированных друг относительно друга зерен (кристаллитов). Сами кристаллиты не являются монокристаллами, так как растут в стесненных условиях и не имеют совершенную структуру.
Примеры кристаллических решеток
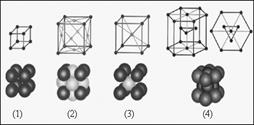
1 – простая кубическая решетка; 2 – гранецентрированная кубическая решетка; 3 – объемоцентрированная кубическая решетка; 4 – гексагональная решетка.
2) Особенности и характер взаимного расположения.
В зависимости от уровня симметрии различают 7 кристаллических систем (сингоний): гексагональная, тригональная, тетрагональная, кубическая, ромбическая, моноклинная и триклинная сингонии. При этом различают 14 пространственных решеток.
Около 25 элементов обладают полиморфизмом, т.е могут образовывать более одной кристаллической структуры (напр. углерод).
3) Виды и концентрация дефектов.
Дефект – нарушения полностью упорядоченного расположения частиц (атомов, ионов, молекул), характерного для идеального кристалла. Образуются в процессе роста кристалла из расплава или раствора, а также под влиянием внешних воздействий (тепловых, электрических, механических, при различных видах облучения), при введении примесей.
Различают 4 вида дефектов:
Точечные (нульмерные) дефекты. Размеры дефекта малы в трех направлениях (отсутствие атома или присутствие лишнего атома).
Линейные (одномерные) дефекты. Малы в двух направлениях, а в третьем направлении могут быть соизмеримы с размером кристалла (отсутствие (дислокация) цепочки атомов).
Поверхностные (двухмерные). Малы в одном направлении, имеют плоскую форму (границы зерен или кристаллов, внешняя поверхность кристалла).
Объемные (трехмерные). Довольно большие размеры в трех направлениях (пустоты, полости, трещины)
Виды дефектов
1, 2 - дефекты поверхности кристалла: 1 - изменение габитуса, 2 - вицинали и макротрещины;
3 - дислокации и малоугловые межблочные границы;
4а - гетерофазные включения и границы блоков,
4б - примесный атом в узле решетки;
5 - дефекты Шоттки (пара вакансий пара ионов на поверхности) и Френкеля (пара вакансия ион в междоузлии).
5) Состав и строение фаз.
Наличие фаз характерно для сложных систем
Фаза – это часть системы, имеющая одинаковый по всему объему
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.