(продолжение)
2. Соль образована слабой кислотой и сильным основанием, например ацетат натрия NaCH3COO, карбонат натрия (сода) Na2CO3, нитрит натрия NaNO2, сульфит натрия Na2SO3, сульфид натрия Na2S, цианид натрия NaCN. Карбонат натрия диссоциирует:
Na2CO3 = 2Na+
+ ![]() .
.
Гидролизу подвергается карбонат-ион. Гидролиз проходит в две ступени:
![]() + Н2О =
+ Н2О = ![]() + ОН–,
+ ОН–,
![]() + Н2О = Н2CO3 +
ОН–.
+ Н2О = Н2CO3 +
ОН–.
В водном растворе гидролиз по второй ступени не проходит – из раствора соды углекислый газ не выделяется. Чтобы гидролиз прошел по второй ступени, равновесие следует сместить вправо добавлением в раствор кислоты (ионов водорода). Образующаяся при этом неустойчивая угольная кислота распадается на углекислый газ и воду:
H2CO3 = СО2 (г.) + Н2О.
Обычно приводимое в учебниках химии уравнение реакции между карбонатом натрия и кислотой с образованием углекислого газа
Na2CO3 + 2НCl = 2NaCl + H2CO3
представляет собой смещенную вправо реакцию гидролиза. Кроме того, это не реакция обмена, а реакция гидролиза, проходящая по второй ступени. Как реакция обмена она протекает при действии газообразного хлороводорода на кристаллический карбонат натрия.
Пример. Рассчитать рН 0,1М раствора карбоната натрия. Будем считать, что гидролиз проходит только по первой ступени:
![]() + Н2О =
+ Н2О = ![]() + ОН–.
+ ОН–.
После преобразований константы гидролиза получаем:
![]()
В этом выражении Ккисл есть константа диссоциации иона ![]() :
:
![]() =
= ![]() + Н+,
+ Н+,
![]()
Обратите внимание, что в расчете используется константа диссоциации кислоты H2CO3 по второй ступени! Для угольной кислоты из справочных данных находим:
|
Н2СО3
= |
| | | |
К1 = 4,31•10–7, |
|
|
К2 = 5,61•10–11. |
Эти данные подставляем в формулу:
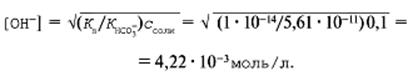
рОН = –lg 4,22•10–3 = 2,4, рН = 14 – рОН = 11,6.
При какой концентрации раствора гидроксида натрия в воде достигается то же значение рН? Рассчитайте. Можно дать приблизительный ответ. А как быть, если вас попросят написать уравнение гидролиза кислой соли, например гидрокарбоната натрия NaHCO3? Если вы сразу же напишите уравнение диссоциации соли
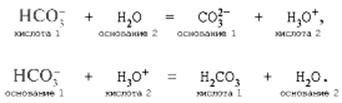
NaHCO3 = Na+ + ![]() , то, очевидно, гидролизу подвергается ион
, то, очевидно, гидролизу подвергается ион ![]() и уравнение гидролиза имеет вид:
и уравнение гидролиза имеет вид:
![]() + Н2О = Н2СO3 +
ОН–.
+ Н2О = Н2СO3 +
ОН–.
Образование неустойчивой угольной кислоты приводит к тому, что уже при слабом нагревании начинается выделение из раствора углекислого газа (тесто с добавленным в него пекарским порошком «поднимается»). По теории кислот и оснований И.Н.Брёнстеда кислотный ион может быть и кислотой, и основанием в зависимости от того, записано ли уравнение реакции гидролиза или уравнение взаимодействия с ионом водорода:
3. Соль образована слабым основанием и слабой кислотой, например ацетат аммония NH4CH3COO, гидрокарбонат аммония NH4HCO3, гидросульфит аммония NH4HSO3, нитрит аммония NH4NO2. Гидролиз такой соли рассмотрим на примере ацетата аммония, диссоциирующего в водном растворе по уравнению
NH4CH3COO = ![]() + CH3COO–.
+ CH3COO–.
Оба иона этой соли образуют с водой слабые электролиты – гидроксид аммония и уксусную кислоту, поэтому реакцию гидролиза можно описать одним общим уравнением:
![]() + CH3COO– + Н2О =
NН4ОН + СН3СООН.
+ CH3COO– + Н2О =
NН4ОН + СН3СООН.
В связи с тем, что константы диссоциации уксусной кислоты СН3СООН
и гидроксида аммония NН4ОН примерно одинаковы, концентрации ионов
водорода и гидроксид-ионов также примерно равны, и поэтому раствор ацетата
натрия имеет примерно нейтральную среду, рН ![]() 7.
Гидролиз соли (NH4)2S, диссоциирующей по уравнению
7.
Гидролиз соли (NH4)2S, диссоциирующей по уравнению
(NH4)2S = 2![]() + S2–, проходит по двум ступеням:
+ S2–, проходит по двум ступеням:
![]() + S2– + Н2О = NH4ОН
+ НS– (1-я ступень),
+ S2– + Н2О = NH4ОН
+ НS– (1-я ступень),
![]() + НS– + Н2О = NH4ОН
+ Н2S (2-я ступень).
+ НS– + Н2О = NH4ОН
+ Н2S (2-я ступень).
В отличие от двух предыдущих вариантов гидролиза (соль образована сильной кислотой и слабым основанием или слабой кислотой и сильным основанием) в данном случае рН раствора не зависит от концентрации соли (но зависит от того, какой из одноименных ионов дополнительно введен в раствор).
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.