|
Частица |
Атом мишени |
|
Е* << φ2Е1, эВ |
|
|
Электрон |
Li |
1,4* |
– |
104 |
|
– " – |
U |
1,5 |
– |
106 |
|
Протон |
Li |
1,8 |
10–2 |
10 |
|
– " – |
U |
4,6 |
10–3 |
103 |
|
Тяжелый ион (М1 = 100) |
Li |
3,8 |
10–4 |
10 |
|
– " – |
U |
5,7 |
10–6 |
103 |
|
*Примечание. Далее будет показано, что (a0/a)2 ~ (z1z2)1/3. |
||||
Для заряженных частиц с массой, по крайней мере, не меньшей массы протона, классическое приближение справедливо. Хотя электрон заряжен и имеет величину а, сравнимую с величиной а для протона, его масса очень мала, и его столкновения должны быть отнесены к разряду квантовых.
Кроме того, энергия электрона
должна иметь порядок m0с2
(~0,5 МэВ), чтобы представлять интерес для теории атомных повреждений (Е1
≥ m0с2), поэтому
необходимо применять релятивистскую квантовую механику. Уравнение ![]() при этом не выполняется. Для электрона
при этом не выполняется. Для электрона
|
, (4.11)
см. лекцию 9.
Это наиболее фундаментальный вопрос, без анализа которого невозможно детально рассматривать задачу о столкновении частиц.
Межатомный потенциал V(r) учитывает взаимодействие между электронами и ядрами сталкивающихся частиц. Мы уже ввели боровский радиус. Обозначим через D расстояние между ближайшими атомами в кристалле (за характерную величину D для большинства кристаллов можно принять: D ~ 2,5 Å). Проведем качественную графическую (достаточно грубую) классификацию используемых потенциалов.
|
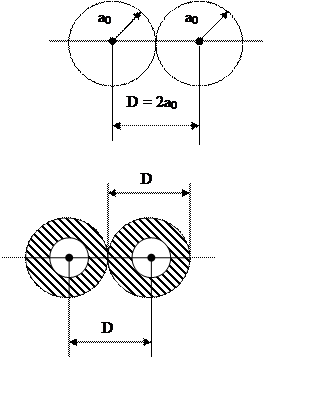 |
Атомы вещества мишени
(графики даны в планетарной модели)
1. r≥D , электронные оболочки не перекрываются (r – расстояие между частицами). Справедлив потенциал Борна-Майера (Б-М, см. ниже)
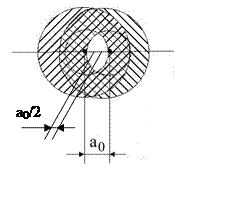 |
2. Между ядрами уже нет электронов. Если r<a0/2, справедлив простой кулоновский потенциал.
3. ao/2≤r<D, справедлив экранированный кулоновский потенциал Томаса-Ферми (Т-Ф) и другие правдоподобные потенциалы (см. ниже).
1. При сближении атомов их внешние оболочки перекрываются, образуются химические связи (ионная, ковалентная, металлическая). Существуют также ван-дер-ваальсовы силы (межмолекулярные). Соответствующие энергии очень малы (порядка нескольких эВ), и при энергиях бомбардирующих частиц, достаточных для создания радиационных повреждений (т.е. имеющих на порядки большие энергии), этими взаимодействиями можно пренебречь.
2. Когда a0 < r < D, перекрываются внутренние заполненные оболочки. По принципу Паули это ведет к повышению энергии (электроны могут только подниматься по энергии, т.к. только два электрона могут находиться в одном состоянии). Этот эффект известен как эффект отталкивания заполненных атомных оболочек и дает важный вклад в потенциальную энергию в этой области.
Разными авторами было найдено, что для пар инертных газов при а0 < r < D справедлив следующий вид потенциала:
V (r) = A e–r/b. (4.12)
Он был использован для ионных кристаллов Борном и Майером и получил название потенциала Борна-Майера. В ионных кристаллах ионы имеют такую же конфигурацию, как инертные газы и для них этот потенциал также справедлив.
3. Когда r << a, и ядра становятся ближайшей парой наиболее сильно заряженных частиц в системе, их потенциал преобладает над потенциалом других заряженных частиц (электронов). В этом случае справедлив простой кулоновский потенциал
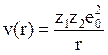 . (4.13)
. (4.13)
4. При увеличении r в пространстве между ядрами оказываются сначала самые глубокие внутренние оболочки. Теперь мы имеем дело уже с экранированным кулоновским потенциалом. Томас и Ферми предложили метод расчета эффективной плотности заряда вокруг атома и оценили V(r). Простой функции нет, но при r > a0 хорошим приближением является функция
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.