Измерительная чаша имеет форму круга разделенного пополам. На каждой половине имеется платиновая подложка, на которую помещается два платиновых тигелька d=5 мм. Один из тигельков является тиглем сравнения и остается пустым, во второй помещается исследуемый образец, масса навески 10-20 мг. К обеим подложкам подведены термопары.
При нагревании снимается ток с термопары, т.к. масса образца неизменна и мала, а время нагрева достаточно велико, то оба тигля нагреваются равномерно и ток на термопарах одинаков. При температуре фазового перехода, будь то α-β переход или плавление, ΔHф.п.>0 , что означает, что означает, что тепло будет поглощаться, что означает остановку в нагреве образца до тех пор, пока все вещество не подвергнется фазовому переходу. Одновременно пустой тигелек сравнения будет нагреваться. Образуется разница температур, а, следовательно, и токов термопар, что и измеряется прибором.
Так же измерительная чаша соединена с блоком измерения массы, что позволяет измерять изменения массы в процессе нагрева.
Внутренняя область блока нагрева продувается газом для улучшения теплопередачи и более равномерного распределения тепла по блоку. Так же на данном приборе в процессе нагрева можно продувать газ, вступающий в реакцию с веществом. В данной работе такой необходимости не было, и в качестве продуваемого газа использовался азот.
Получаемые данные.
При обработке данных на компьютере выводились три кривые в зависимости от времени измерения.
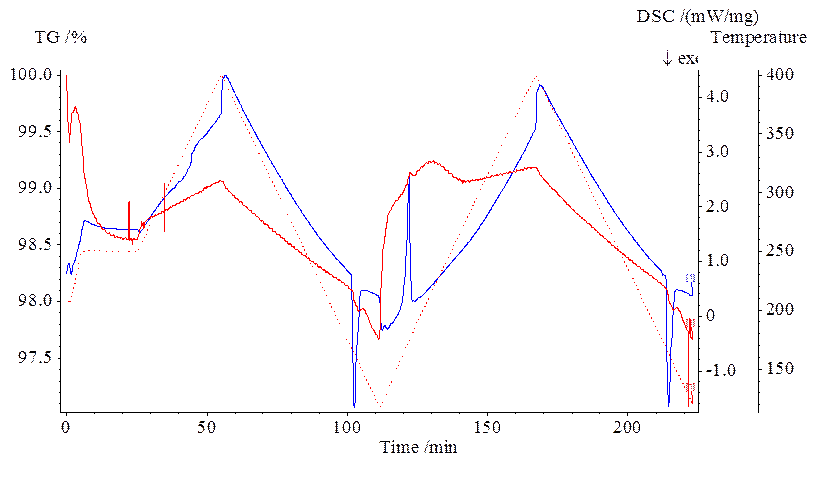
Красная линия точками – запрограммированная кривая температура блока нагрева
Красная сплошная линия – относительное (в %) изменение массы образца. Первоначальное падение массы обусловлено отщеплением закристаллизованной воды. Последующие колебания в 1-2% объясняются неравномерностью потоков продуваемого газа и их взаимодействием с измерительной чашей.
Синяя линия – разница токов термопар тигля сравнения и тигля с образцом. Начало пиков этой кривой соответствует температуре плавления.
Полученные данные.
По обработанным данным построена фазовая диаграмма системы КОН-NaOH.
|
Содержание КОН %масс |
Температура ф.п. |
|
0 |
322,6 |
|
0 |
299,0335 |
|
20 |
262,513 |
|
25 |
259,0155 |
|
40 |
210,894 |
|
50 |
170,16715 |
|
60 |
181,521 |
|
75 |
230,8415 |
|
100 |
247,7 |
|
100 |
404,10667 |
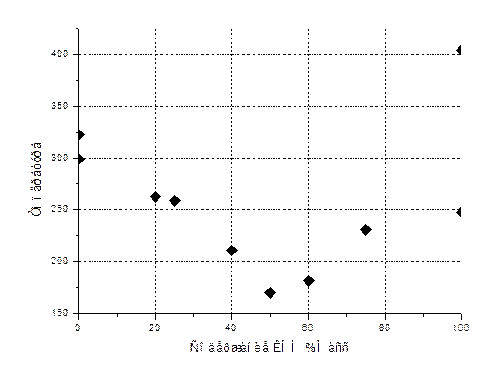
Сравнение с литературными данными.
В качестве сравнения взяты данные из справочника “Диаграммы плавкости солевых систем Ч.II” под редакцией В.И. Посыпайко, Е.А. Алексеевой Москва «Металлургия» 1977 г. С ссылкой на Решетников Н.А., Бергман А.Г. – «Изв. Физ.-Хим. Науч. Исслед. Ин-та при Иркутск. гос. Ун-те.» 1959, Т. 4, в. 1, с. 9.
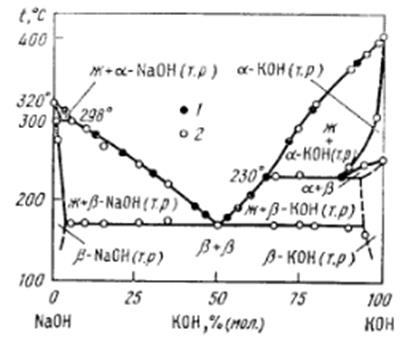
Сравнение нонвариантных точек:
|
Характеристика точки |
Тлит. 0С |
Тэкс 0С |
|
α-β переход NaOH |
300 |
299 |
|
Плавление NaOH |
320 |
322,6 |
|
Точка эвтектики |
170 |
170,17 |
|
α-β переход KOH |
250 |
247,7 |
|
Плавление KOH |
404 |
404,1 |
δотнос= 0,254%, что позволяет считать данные совпадающими.
Список литературы.
1. Н. М. Бажин, В. А. Иванченко, В. Н. Пармон Термодинамика для химиков: Учебное пособие. Ч.2 / Новосиб. ун-т. Новосибирск, 1999. С 101 – 106.
2. В. Н. Пармон, В. А. Иванченко. Основы химической термодинамики. Новосибирск: НГУ, 1998.
3. В. П. Древинг, Я. А. Калашников. Правило фаз. М.: МГУ, 1964.
4. О. М. Полторак. Термодинамика в физической химии. М.: Высш. шк., 1991
.
5. М. Х. Карапетянц. Химическая термодинамика. М.: Химия, 1975.
6. Г. А. Голиков. Руководство по физической химии. М.: Высшая школа, 1988.
7. Ф. Даниэльс, Р. Ольберти. Физическая химия. М.: Мир, 1978.

термовесы NetzchSTA 449CJupiter
внешний вид
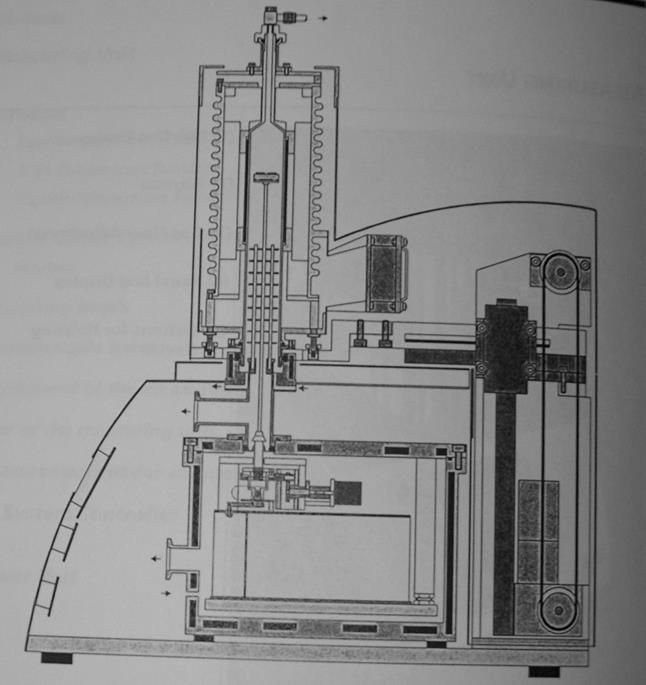
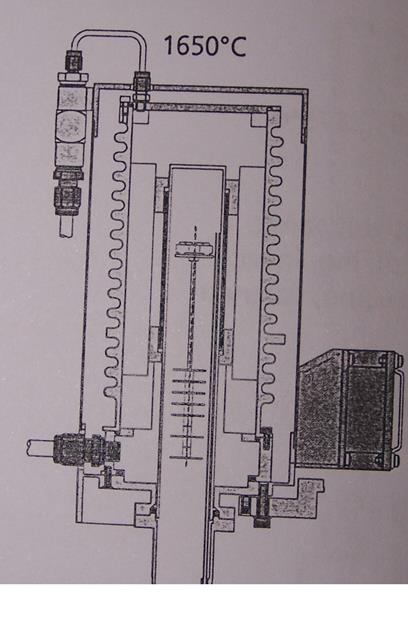
Схема прибора Схема блока нагрева
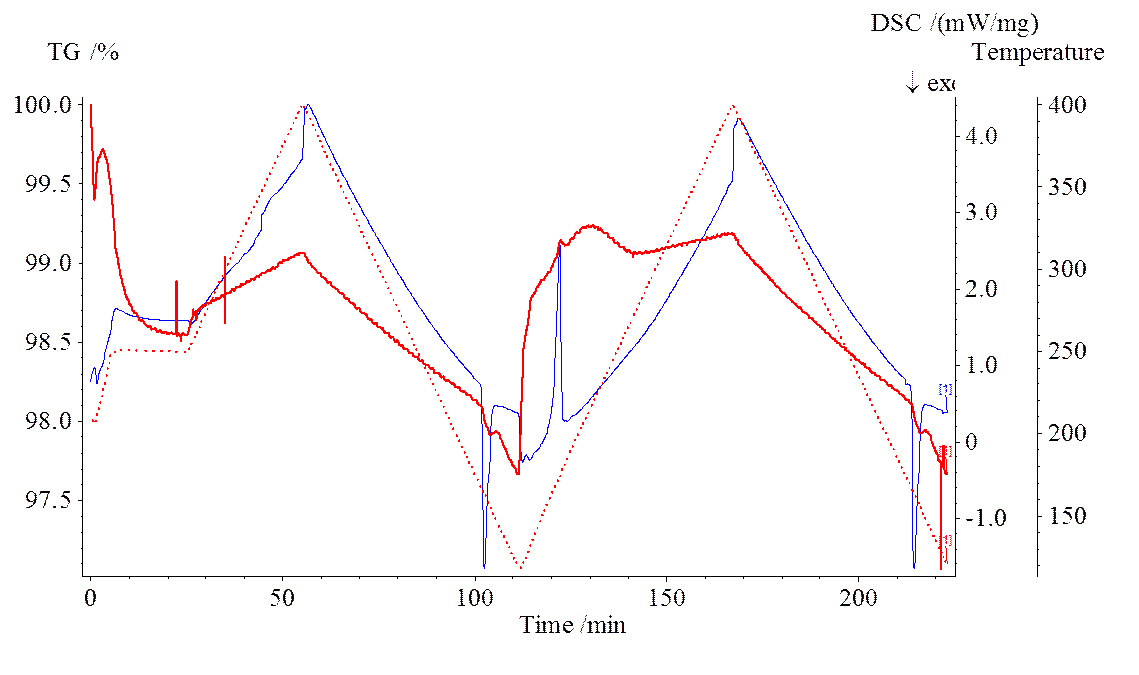
Пример графика
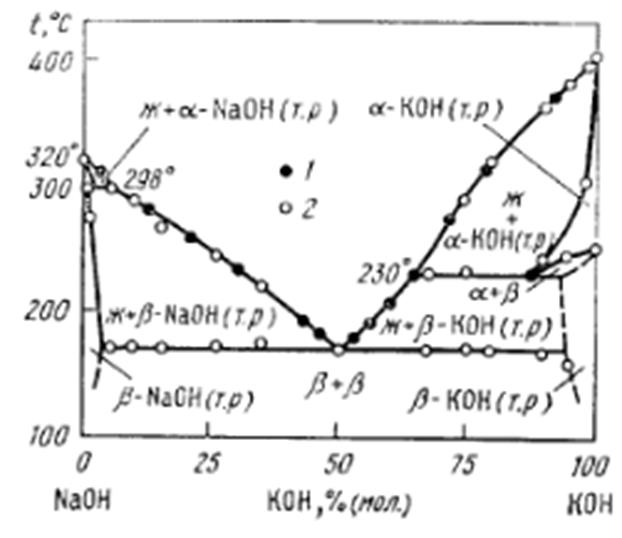
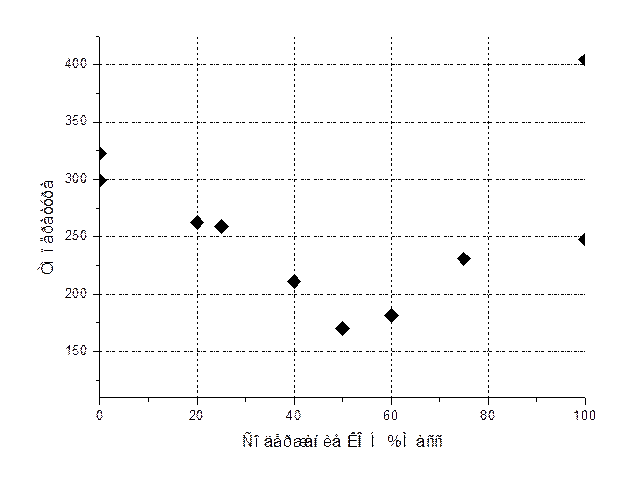
Литературные данные Экспериментальные данные
δотнос= 0,254%
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.