|
t cек |
V мл |
V0-V |
(V0)/(V0-V) |
ln((V0)/(V0-V)) |
|
148 |
5 |
303 |
1,01650165 |
0,016367 |
|
306 |
10 |
298 |
1,033557047 |
0,033006 |
|
479 |
15 |
293 |
1,051194539 |
0,049927 |
|
656 |
20 |
288 |
1,069444444 |
0,067139 |
|
836 |
25 |
283 |
1,088339223 |
0,084653 |
|
1034 |
30 |
278 |
1,107913669 |
0,102479 |
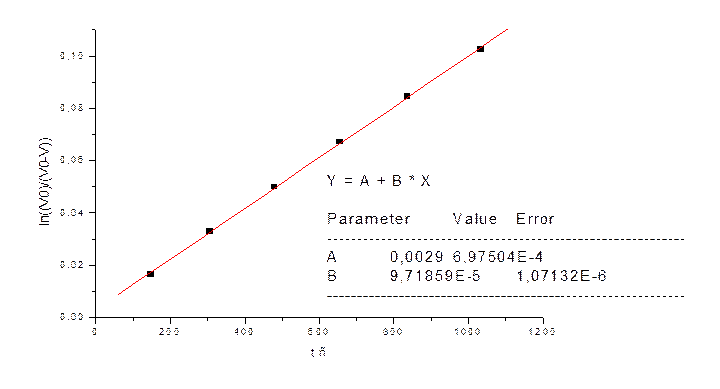
2)
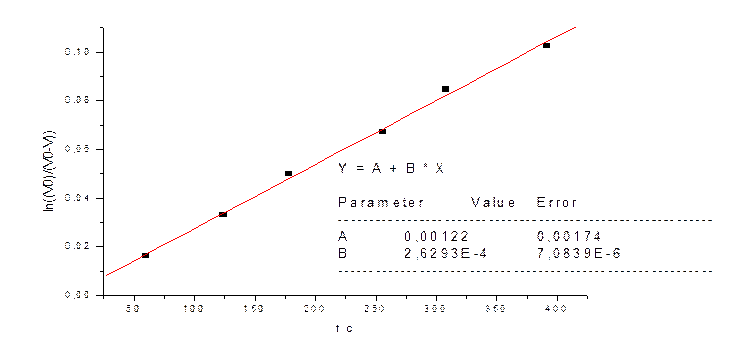
|
t cек |
V мл |
V0-V |
(V0)/(V0-V) |
ln((V0)/(V0-V)) |
|
60 |
5 |
303 |
1,01650165 |
0,016366977 |
|
124 |
10 |
298 |
1,033557047 |
0,033006296 |
|
178 |
15 |
293 |
1,051194539 |
0,049927174 |
|
256 |
20 |
288 |
1,069444444 |
0,067139303 |
|
308 |
25 |
283 |
1,088339223 |
0,084652885 |
|
391 |
30 |
278 |
1,107913669 |
0,102478669 |
3)
|
t cек |
V мл |
V0-V |
(V0)/(V0-V) |
ln((V0)/(V0-V)) |
|
6 |
10 |
298 |
1,033557047 |
0,033006296 |
|
20 |
15 |
293 |
1,051194539 |
0,049927174 |
|
38 |
20 |
288 |
1,069444444 |
0,067139303 |
|
56 |
25 |
283 |
1,088339223 |
0,084652885 |
|
78 |
30 |
278 |
1,107913669 |
0,102478669 |
|
101 |
35 |
273 |
1,128205128 |
0,120627988 |
|
126 |
40 |
268 |
1,149253731 |
0,139112802 |
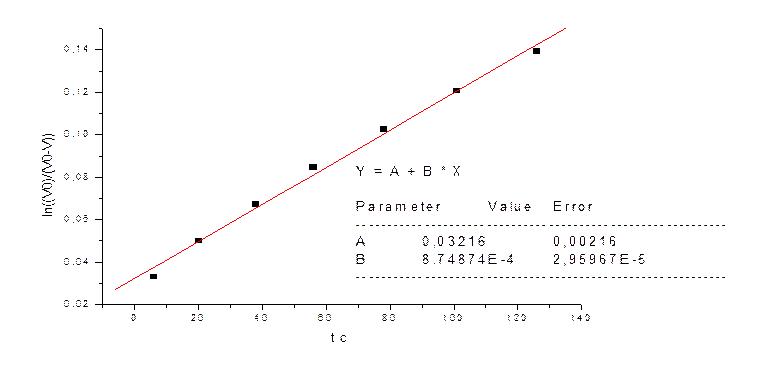 1
1
1) kэфф=9,7*10-5 при СFe =0.0063M,
2) kэфф=2,6*10-4 при СFe=0.0125M,
3) kэфф=8,7*10-4 при СFe=0.025M
Данные при 35 0С при СFe=0.0125M
|
t cек |
V мл |
V0-V |
(V0)/(V0-V) |
ln((V0)/(V0-V)) |
|
19 |
5 |
298 |
1,033557047 |
0,033006296 |
|
38 |
10 |
293 |
1,051194539 |
0,049927174 |
|
56 |
15 |
288 |
1,069444444 |
0,067139303 |
|
79 |
20 |
283 |
1,088339223 |
0,084652885 |
|
102 |
25 |
278 |
1,107913669 |
0,102478669 |
|
121 |
30 |
273 |
1,128205128 |
0,120627988 |
|
144 |
35 |
268 |
1,149253731 |
0,139112802 |
|
171 |
45 |
263 |
1,171102662 |
0,157945751 |
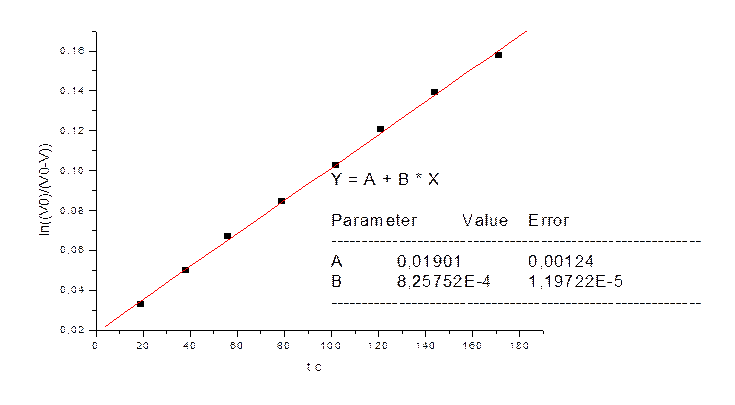
Данные при 45 0С при СFe=0.0125M
|
t cек |
V мл |
V0-V |
(V0)/(V0-V) |
ln((V0)/(V0-V)) |
|
6 |
5 |
303 |
1,01650165 |
0,016366977 |
|
14 |
10 |
298 |
1,033557047 |
0,033006296 |
|
21 |
15 |
293 |
1,051194539 |
0,049927174 |
|
28 |
20 |
288 |
1,069444444 |
0,067139303 |
|
35 |
25 |
283 |
1,088339223 |
0,084652885 |
|
42 |
30 |
278 |
1,107913669 |
0,102478669 |
|
49 |
35 |
273 |
1,128205128 |
0,120627988 |
|
56 |
40 |
268 |
1,149253731 |
0,139112802 |
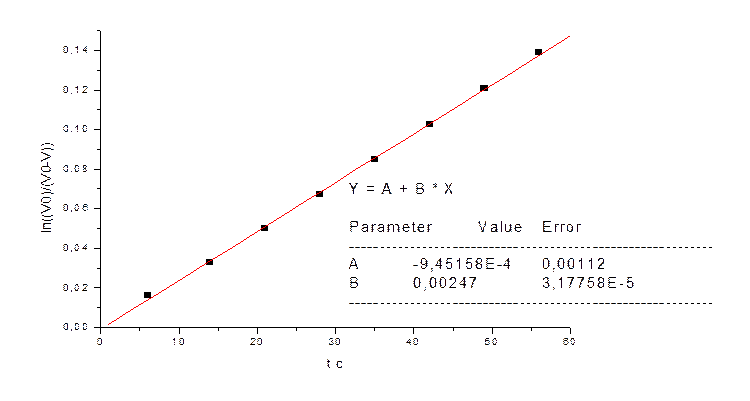
Зависимость kэфф от температуры:
|
1/T |
0.003356 |
0.003247 |
0.003145 |
|
ln (kэфф) |
-8,24 |
-7,10 |
-6,00 |
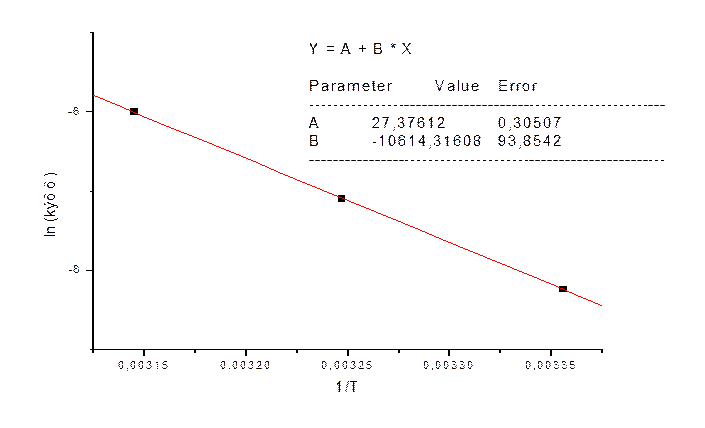
Ea=-B*8.31=88.2 кДж/моль, Из k=k0*e-(Ea/RT) → k0=9.55*10121/c~1013 1/c.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.