



З А Н Я Т И Е N 7
ТЕМА: Карбоновые кислоты и их функциональные производные
1. ЗНАЧИМОСТЬ ИЗУЧАЕМОЙ ТЕМЫ: Карбоновые кислоты, их соли,
сложные эфиры широко распространены в природе. Они имеют большое значение в метаболических процессах. Присутствие карбоксильной группы в молекуле сложного вещества увеличивает его растворимость в воде. В медицине широко применяются кислоты и их соли как лекарственные вещества (СН3СООК - диуретическое средство, ацетат свинца - вяжущее средство, изовалериановая кислота оказывает успокаивающее действие в составе валидола и т.д.). Многие лекарственные средства содержат в своем составе сложноэфирные группы.
2. ЦЕЛЬ ЗАНЯТИЯ: Сформировать знания химических свойств карбонилсодержащих соединений для понимания их реакционной способности, обуславливающей протекание ряда реакций в биологических системах.
3. ЗАДАЧИ: после изучения темы
студент должен знать:
- электронное строение карбоксилат - иона; реакционные центры в молекуле карбоновой кислоты;
- классификацию и номенклатуру карбоновых кислот;
- химические свойства карбоновых кислот и механизмы химических реакций с их участием;
- строение и химические свойства функциональных производных карбоновых кислот; сложных эфиров, тиоэфиров, амидов, ангидридов.
студент должен уметь:
- составлять структурные формулы карбоновых кислот и давать им названия по радикально - функциональной и заместительной номенклатуре ИЮПАК;
- составлять уравнения реакций взаимодействия карбоновых кислот со спиртами и тиолами, протекающими по механизму нуклеофильного замещения;
- составлять уравнения реакций получения амидов, галогенангидридов и ангидридов карбоновых кислот;
- составлять уравнения реакций гидролиза сложных эфиров, тиоэфиров, амидов и описывать механизм их протекания;
- составлять уравнения реакций галогенирования карбоновых кислот, протекающих по СН-кислотному центру;
- составлять уравнения реакций декарбоксилирования карбоновых кислот; выполнять сравнительную характеристику силы карбоновых кислот.
приобрести практические навыки:
- по моделированию строения и прогнозирования реакционной способности карбоновых кислот и их функциональных производных;
- по качественному определению карбоксильной группы в органических соединениях и идентификации функциональных производных карбоновых кислот.
ОСНОВНЫЕ ВОПРОСЫ ТЕМЫ:
1. Электронное строение карбоксилат-иона.
2. Классификация органических кислот.
3. Механизм реакций нуклеофильного замещения в карбоновых кислотах.
4. Функциональные производные карбоновых кислот-сложные эфиры, амиды, их гидролиз. Тиоэфиры и их биологическое значение.
5. Высшие жирные кислоты, применение солей высших жирных кислот.
ВСПОМОГАТЕЛЬНЫЕ МАТЕРИАЛЫ (ОСНАЩЕНИЕ ЗАНЯТИЯ)
1. Методические указания для студентов по теме "Карбоновые кислоты и их функциональные производные".
2. Учебные таблицы:
а) периодическая система химических элементов Д.И. Менделеева (1);
б) таблица старшинства функциональных групп по классификации ИЮПАК (12);
в) таблица "Электронные эффекты заместителей" (13);
3. Химическая посуда: пробирки, пипетки, спиртовки, водяные бани;
4. Реактивы, необходимые для проведения лабораторной работы;
1. Приведите электронное строение карбоксильной группы и карбоксилат-аниона. Покажите влияние электронодонорных и электроакцепторных заместителей в радикале на изменение кислотности на примере следующих кислот: щавелевой, уксусной, моно-, ди- и трихлоруксусных кислот.
2. Объясните повышенную активность атома водорода при углеродном атоме (СН-кислотность) в карбоновых кислотах. Напишите реакцию галогенирования пропионовой и масляной кислоты.
3. Опишите механизм реакции нуклеофильного замещения (SN) на примере реакции этерификации изопропилового спирта и валериановой кислоты.
4. Напишите уравнение реакций получения ангидридов янтарной и малеиновой кислот, хлорангидрида пропионовой кислоты, Nа-соли стеариновой кислоты.
5. Напишите схему реакции декарбоксилирования щавелевой и малоновой кислот.
6. Напишите уравнение реакции гидрирования олеиновой кислоты.
ПЕРЕЧЕНЬ СОЕДИНЕНИЙ, ФОРМУЛЫ КОТОРЫХ
НУЖНО ЗНАТЬ К ЗАНЯТИЮ:
1. Пальмитиновая 5. Салициловая
2. Стеариновая 6. Ацетилсалициловая
3. Аспарагиновая 7. Никотиновая
4. Глутаминовая 8. Ацетоуксусный эфир
ЛАБОРАТОРНАЯ РАБОТА N 7
ОПЫТ 1. Получение и гидролиз ацетата железа (III)
В пробирку поместить по 3 капли уксусной кислоты и воды. Испытать реакцию на лакмус. К раствору прибавить по 2-3 капли 10% раствора NaОН до полной нейтрализации. После этого добавить 2-3 к. 1% раствора FeCl3. Появится желто-красное окрашивание. Подогреть раствор до кипения. Выделяется красно-бурый осадок нерастворимого в воде гидроксида диацетата железа.
ФОРМА ОТЧЕТА:
1. Написать краткую методику проведения опыта.
2. Написать схему диссоциации уксусной кислоты.
3. Написать схему реакции образования ацетата железа (III).
4. Написать схему реакции гидролиза ацетата железа.
ОПЫТ 2. Образование нерастворимых солей высших жирных кислот
А. В пробирку с раствором мыла добавить несколько капель 10% раствора хлорида бария. Выпадает белый осадок нерастворимой соли.
В. Гидролиз мыла.
В пробирку с раствором мыла добавить несколько капель спиртового раствора фенолфталеина. Объяснить появление розовой окраски.
ФОРМА ОТЧЕТА:
1. Методика проведения опытов А и В
2. Уравнение реакций образования нерастворимых солей высших жирных кислот (стеаратов натрия) и уравнение гидролиза стеарата натрия.
3. Почему растворы мыл имеют щелочную реакцию?
ОПЫТ 3. Омыление жира
К 0,5 мл подсолнечного масла прилить 0,5 мл 30% раствора гидроксида натрия и смесь осторожно кипятить 5-6 минут. Омыление считают законченным, если взятая стеклянной палочкой капля жидкости полностью растворится в дистиллированной воде с образованием пены.
ФОРМА ОТЧЕТА:
1. Кратко описать методику проведения опыта.
2. Привести уравнения реакции омыления растительного жира на примере олеиновой кислоты. Назвать продукты.
3. К какому типу реакций относится реакция омыления жира?
ОПЫТ 4. А. Окисление олеиновой кислоты перманганатом калия
В пробирку поместить 2 капли олеиновой кислоты, 2 капли 1% раствора перманганата калия и 1 каплю 5% раствора карбоната натрия. При встряхивании розовая окраска исчезает, что указывает на окисление олеиновой кислоты по месту двойной связи.
В. Присоединение брома к олеиновой кислоте
В пробирку внести 0,5 мл бромной воды, добавить 3-4 капли олеиновой кислоты и энергично взболтать. Объяснить причину обесцвечивания бромной воды.
ФОРМА ОТЧЕТА:
1. Кратко описать методику опыта.
2. Привести схему описания реакций. Назвать продукты.
3. Объясните возможность взаимодействия олеиновой кислоты с KMnO4 и Вr2.
ОПЫТ 5. Получение этилацетата
В сухую пробирку поместите порошок безводного ацетата натрия (высота около 2 мм) и 0,5 мл этилового спирта (на общем столе). К полученной смеси добавьте 2-5 капель концентрированной серной кислоты (в вытяжном шкафу) и осторожно немного нагрейте над пламенем спиртовки (следите за тем, чтобы смесь не выплеснулась). Через несколько секунд появляется приятный освежающий запах этилацетата. Реакция используется для открытия этилового спирта.
ФОРМА ОТЧЕТА:
1. Кратко описать методику опыта.
2. Привести схему описания реакции, механизм реакции.
3. Объяснить роль концентрированной серной кислоты в реакции этерификации.
МАТЕРИАЛЫ УИРС:
Ацетилкофермент А
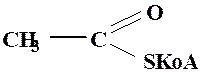
in vivo служит переносчиком ацетильной группы на нуклеофильные субстраты (превращение холина в ацетилхолин). Сравнить способность к нуклеофильному замещению обычных сложных эфиров и тиоэфиров карбоновых кислот.
ЛИТЕРАТУРА
ОСНОВНАЯ:
1. Конспект лекций.
2. Тюкавкина Н.А., Бауков Ю.И. Биоорганическая химия: Учеб. для студ. мед. институтов. - 2-е изд.перераб и доп. - М.: Медицина, 1991. - с. 194-213.
3. Руководство к лабораторным занятиям по биоорганической химии/ Под ред. Н.А. Тюкавкиной. - М: Медицина, 1985. - с.108-118.
ДОПОЛНИТЕЛЬНАЯ:
1. Г. Тейлор. Основа органической химии для студентов нехимических специальностей. - М: Мир, 1989. - с. 113-141.
2. Степаненко Б.Н. Курс органической химии: Учеб.для студ. мед. институтов. - 3-е изд. перераб и доп. - М.: Высшая школа, 1979. - с. 208-240.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.