


























Министерство здравоохранения Республики Беларусь
Учреждение образования
«Гомельский государственный медицинский университет»
Кафедра_________________________________________________
Обсуждено на заседании кафедры (МК или ЦУНМС)____________________
Протокол № _______
ЛЕКЦИЯ
По биологической химии
для студентов_____2-го_____ курса ___лечебного___________________факультета
Тема:___Белки 2. Тканевой обмен аминокислот
Время__90 мин___________________
Учебные и воспитательные цели:
1.Сформировать представление об основных путях метаболизма
свободных аминокислот в тканях.
2.Изучить механизмы и значение реакций детоксикации аммиака в норме и
при патологии.
МАТЕРИАЛЬНОЕ ОБЕСПЕЧЕНИЕ
1.Мультимедийная презентация
РАСЧЕТ УЧЕБНОГО ВРЕМЕНИ
|
№п/п |
Перечень учебных вопросов |
Количество выделяемого времени, мин. |
|
1. |
Пути метаболизма аминокислот |
45 |
|
2. |
Токсичность аммиака и пути его обезвреживания |
45 |
Всего: 90 минут
Азот аминогруппы в дальнейшем может использоваться для синтеза других соединений или выделяться из организма. Животный мир делится на несколько групп в зависимости от конечного азотсодержащего продукта. Это определяется доступностью воды в той экологической нише, которую занимает это животное. Рыбы выделяют азот непосредственно в воду в форме аммиака, что позволяет быстро избавиться от этого токсического соединения (аммонотелические организмы). У птиц азот выделяется в форме мочевой кислоты, плохо растворимого в воде соединения (урикотелические организмы), а у остальных животных в составе относительно нетоксического и хорошо растворимого в воде соединения – мочевины (уреотелические организмы).У человека азот выделяется почками в виде следующих соединений
|
Продукт |
% выделенного азота |
|
Мочевина |
86 |
|
Креатинин |
4.5 |
|
ионы аммония |
2.8 |
|
мочевая кислота |
1.7 |
|
другие соединения |
5.0 |
Существует 2 типа реакции, удаляющих аминогруппу:
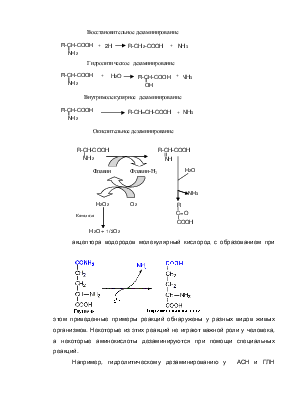
Реакции прямого дезаминирования позволяют получить свободный аммиак.
![]() R-CH-COOH
R-C-COOH + NH4+
R-CH-COOH
R-C-COOH + NH4+
NH3 O
 |
a-кетоглутаровую кислоту)) с последующей реакцией прямого дезаминирования образовавшейся аминокислоты ( главным образом глутаминовой)
Различают несколько типов реакций прямого дезаминирования.
Возможны четыре механизма прямого дезаминирования:


акцептора водородов молекулярный кислород с образованием при этом п
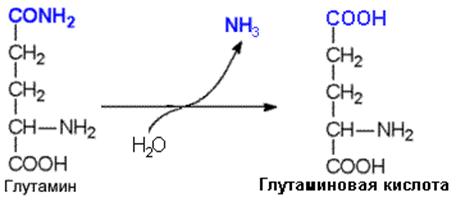 |
Например, гидролитическому дезаминированию у АСН и ГЛН подвергаются амидные группы этих аминокислот
Прямому дезаминированию подвергаются ГИС и ГЛИ

СЕР и ТРЕ – гидроксиаминокислоты. Они дезаминируются путем дегидратации при участии серин-треонин дегидратазы.
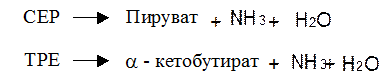
Окислительное дезаминирование некоторых аминокислот катализируется флавинзависимыми дегидрогеназами. Эти ферменты обладают выраженной стереохимической специфичностью к D- и L- аминокислотам. Они названы оксидазами аминокислот из-за их способности использовать в качестве конечного оксида водорода. Выделенная из тканей почек и печени оксидаза L-аминокислот имела оптимум рН в щелочной среде и при физиологических условиях обладала очень низкой активностью. Значительно более высоко активны оксидазы D-аминокислот. Роль таких различий в активности оксидаз остается непонятной.
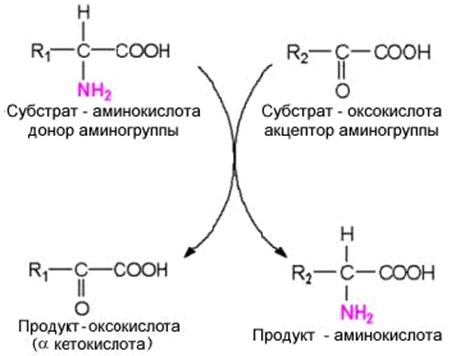 |
Большинство аминокислот теряют свою аминогруппу не путем описанного выше
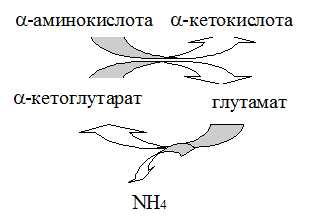
. Схема переаминирования.
 прямого дезаминирования, а передают аминогруппу на
кетокислотный акцептор. Эти реакции катализируются группой ферментов,
получивших название трансаминаз. Коферментом их является пиридоксальфосфат. Это
главный путь удаления азота у аминокислот. Выделены трансаминазы,
катализирующие переаминирование большинства аминокислот. После поступления
пищевых аминокислот из воротной вены, например, значительная часть их в печени
подвергается переаминированию. Исключением являются аминокислоты с разветвленным
углеводородным радикалом, для которых в печени нет соответствующих трансаминаз,
о чем говорит более высокая концентрация таких аминокислот в крови, оттекающей
от печени по сравнению с концентрацией в крови воротной вены.
прямого дезаминирования, а передают аминогруппу на
кетокислотный акцептор. Эти реакции катализируются группой ферментов,
получивших название трансаминаз. Коферментом их является пиридоксальфосфат. Это
главный путь удаления азота у аминокислот. Выделены трансаминазы,
катализирующие переаминирование большинства аминокислот. После поступления
пищевых аминокислот из воротной вены, например, значительная часть их в печени
подвергается переаминированию. Исключением являются аминокислоты с разветвленным
углеводородным радикалом, для которых в печени нет соответствующих трансаминаз,
о чем говорит более высокая концентрация таких аминокислот в крови, оттекающей
от печени по сравнению с концентрацией в крови воротной вены.
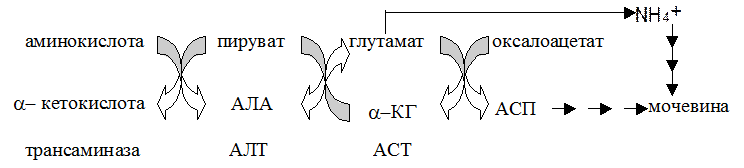
Стратегия реакции переаминирования в клетке - аминогруппы разных донорных аминокислот переносятся на ограниченное число a кетокислотных акцепторов, что позволяет выделить центральный путь метаболизма аминокислот. Большинство трансаминаз использует a-кетоглутаровую кислоту как основной акцептор аминогруппы. Трансаминазы же обычно называют по аминокислотам, которые служат донором аминогруппы. Такая стратегия обеспечивается субстратной специфичностью трансаминаз: каждая трансаминаза специфична для одного или нескольких аминокислотных доноров и одного акцептора (как правило a-кетоглутаровой кислоты хотя оксалоацетат и ПВК также можно рассматривать в качестве важных акцепторов аминогрупп). Наиболее изученными трансаминазами являются:
a.аланиновая трансаминаза (АЛТ), известна также как глутамат:пируват трансаминаза (ГПТ или СГПТ, для фермента в сыворотке крови). Следует заметить, что реакции переаминирования обратимы. В скелетной мышце пируват - главный акцептор для аминогрупп от глутаминовой кислоты, что приводит к образованию больших количеств аланина (последний транспортируется к печени). В печени аланин отдает аминогруппу a -КГ, что вновь ведет к образованию ГЛУ.
б. аспарагиновая трансаминаза (АСТ), известна как глутамат:оксалоацетат трансфераза (ГОТ или СГОТ). Эта реакция важна для печени, где оксалоацетат действует как акцептор аминогрупп, получаемых от ГЛУ. Продукт реакции аспартат является субстратом для синтеза мочевины. Эта реакция, но протекающая в обратном направлении, важна для сердечной мышцы.
Роль трансаминаз в перносе аминного азота на мочевину показана на следующем рисунке .
 |
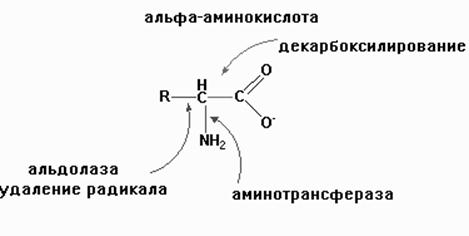 |
Пиридоксальфосфат (ПФ)
является коферментом многих ферментов, которые катализируют реакции,
включающие трансформацию в области a углеродного атома. К ним относятся трансаминазы,
декарбоксилазы, дезаминазы, рацемазы и альдолазы (дегидратазы). Это связано с
тем, что ПФ активирует a
-углеродный атом и делает лабильным одну из трех 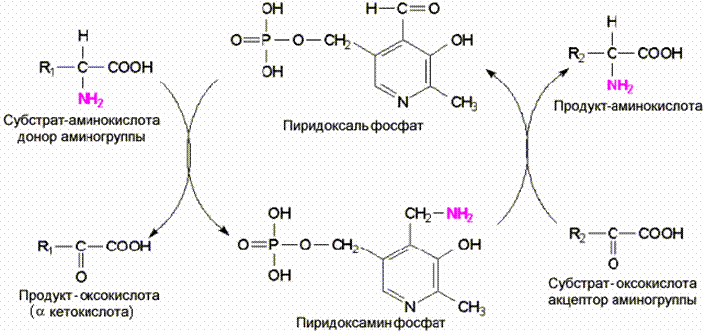
Участие пиридоксальфосфата в мехенизме переноса аминогруппы
 связей соединяющихся с этим атомом. В
трансаминазной реакции он действует как переносчик аминогрупп в двухступенной
реакции. ПФ вначале выполняет функции акцептора аминогруппы от
аминокислоты-донора, образуя пиридоксаминфосфат, во второй половине реакции эта
аминогруппа переносится на a кетокислотный акцептор, регенерируя пиридоксаль-Ф.
связей соединяющихся с этим атомом. В
трансаминазной реакции он действует как переносчик аминогрупп в двухступенной
реакции. ПФ вначале выполняет функции акцептора аминогруппы от
аминокислоты-донора, образуя пиридоксаминфосфат, во второй половине реакции эта
аминогруппа переносится на a кетокислотный акцептор, регенерируя пиридоксаль-Ф.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.