







БИЛЕТ №17
1. Условия образования твердых растворов и фаз внедрения (специальных карбидов, нитридов) в сплавах на основе железа.
Твердый раствор представляет собой основную фазу почти в любом сплаве. Твердый раствор может возникнуть между химическими элементами (Сu — Ni — Si — Fe), между химическими соединениями (NaCl — Кl) и между элементом и химическим соединением (Сr — Fe3C). Неупорядоченный бинарный твердый раствор—это атомарная смесь двух компонентов, фаза переменного состава, в которой атомы растворенного элемента частично замещают атомы растворителя в его кристаллической решетке или располагаются в промежутках между ними.
Из-за взаимодействия атомы в твердых растворах располагаются не совсем беспорядочно и не строго в узлах решетки, а размеры их не совпадают с размерами атомов чистых металлов. В малых объемах решетки обычно встречаются обогащенные сегрегации и обедненные участки, примесные атомы скапливаются вблизи дефектов решетки. В сплаве может возникать ближний порядок, когда число пар разнородных атомов больше, чем при полностью хаотическом распределении.
Соответственно и свойства твердых растворов отличаются от свойств чистых металлов.
В зависимости от расположения атомов растворенного вещества в кристаллической решетке различаются три типа растворов — замещения, внедрения, вычитания.
Твердые растворы замещения
Атомы растворенного элемента занимают узлы кристаллической решетки. Растворение чужеродных атомов приводит, естественно, к изменению состояния кристаллической решетки. Рентгеноструктурный анализ обнаруживает изменение параметра решетки. При этом на небольшом участке состава в сильно разбавленных растворах параметр меняется по линейному закону, а в концентрированных по более сложному. Согласно электрохимической теории, вся теплота смешения определяется типом связи (электроотрицательность, число валентных электронов) между ближайшими соседями, однако если размеры атомов не одинаковы, то теплота смешения зависит не только от типа связи, но и от энергии искажения.
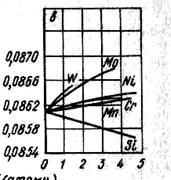 Рис. Параметр твердых растворов замещения,
образующихся при растворении различных элементов в железе
Рис. Параметр твердых растворов замещения,
образующихся при растворении различных элементов в железе
Растворимость компонентов зависит от их относительной валентности. Элементы с более высокой валентностью лучше растворяются в элементах с более низкой валентностью и наоборот. Большая группа растворов подчиняется теории, согласно которой предельная растворимость наступает при достижении критической величины электронной концентрации (т. е. количества электронов ни 1 атом). Например, металлы с решеткой г. ц. к. устойчивы при СЭл = 1,4. Расчет дает для объемноцентрированного куба СЭл = 1,36, а для гранецентрированного куба СЭл = 1,48.
Если размеры атомов растворенного компонента больше размеров атомов металла-растворителя, то параметр реш-ки увеличивается. При обратном соотношении атомов параметр реш-ки уменьшается.
Твердые растворы внедрения
Атомы растворенного элемента внедряются между узлами кристаллической
решетки. Чем меньше размеры атомов растворенного компонента и чем больше по
величине промежутки между атомами растворителя, тем выше концентрация твердого
раствора внедрения. Такие растворы обычно возникают между металлами переходных
групп и неметаллами с малым атомным
радиусом [r<0,1 нм (1,0 ![]() )]—водород,
азот, углерод, бор. Примером растрора внедрения может служить раствор углерода
в γ-железе (аустенит). Известны растворы внедрения на основе химического
соединения, например никеля в NiSb.
)]—водород,
азот, углерод, бор. Примером растрора внедрения может служить раствор углерода
в γ-железе (аустенит). Известны растворы внедрения на основе химического
соединения, например никеля в NiSb.
Условия образования раствора внедрения отличаются от таковых для
растворов замещения. В первом случае требуется определенное соотношение между
размером внедряющегося атома и размером поры в решетке. Размер атома должен
быть больше размера поры, что обеспечивает перекрытие внешних электронных
оболочек при возникновении химической связи, но не слишком, чтобы не было
больших искажений. Максимальный размер поры, находящейся в г. ц. к. решетке
между плоскостями октаэдра (октаэдрическая пора), согласно Гольдшмидту, rx = 0,41rMe,
где rMe — атомный радиус металлического
атома. Так, в сплавах Fe — С, когда железо находится в
γ-модификации (г. ц. к.), rx = 0,41·1,26 =
5,15![]() 10-2 нм (0,515
10-2 нм (0,515 ![]() ) [0,126 нм
(1,26
) [0,126 нм
(1,26![]() ) —атомный радиус железа], а атомный радиус
углерода составляет
7,7·10-2 нм (0,77
) —атомный радиус железа], а атомный радиус
углерода составляет
7,7·10-2 нм (0,77 ![]() ). Размер атома углерода
несколько больше размера октаэдрической поры и углерод растворителя в γ-железе
в значительном количестве (до 2,0%). Когда железо находится в α-модификации (о.
ц. к.), размеры тетраэдрической поры
rx= 3,1·10-2 нм (0,31
). Размер атома углерода
несколько больше размера октаэдрической поры и углерод растворителя в γ-железе
в значительном количестве (до 2,0%). Когда железо находится в α-модификации (о.
ц. к.), размеры тетраэдрической поры
rx= 3,1·10-2 нм (0,31 ![]() ). Но дело даже не в том, какая пора
слишком мала для углерода — надо иметь в виду, что пора в о, ц. к. решетке
является несимметричной (она укорочена по одной из оси), поэтому углерод
практически не растворяется в феррите.
). Но дело даже не в том, какая пора
слишком мала для углерода — надо иметь в виду, что пора в о, ц. к. решетке
является несимметричной (она укорочена по одной из оси), поэтому углерод
практически не растворяется в феррите.
В растворах .внедрения (в отличие от растворов замещения) параметр
решетки всегда возрастает при увеличении концентрации растворенных атомов. Так,
при увеличении концентрации азота в γ-железе с 0,5 до 2,5% параметр аустенита возрастает
(с 3,56 до 3,65 ![]() ). Искажения кристаллической
решетки, которые возникают при образовании растворов внедрения, больше, чем при
образовании растворов замещения.
). Искажения кристаллической
решетки, которые возникают при образовании растворов внедрения, больше, чем при
образовании растворов замещения.
Твердые растворы вычитания
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.