В 1978 г. В. И. Шаповалов совместно с Л. М. Полторацким опубликовал результаты работы по диаграмме состояния железо – углерод – водород. Там показано, что воздействие водорода на структуру железоуглеродистых сплавов разнообразно. Эксперименты, проведенные на сплавах технической чистоты и реже на чистых сплавах, показывают, что водород можно рассматривать как полноправный легирующий элемент даже при небольших его содержаниях. Так, было обнаружено, что он увеличивает склонность к отбелу чугунов, резко тормозит графитизацию, влияет на устойчивость аустенита, изменяет химический состав и структуру сталей и чугунов вследствие обезуглероживания, увеличивает прокаливаемость сталей, смещает температуру эвтектоидного распада. Известны также работы, в которых обнаружено существенное взаимодействие атомов углерода и водорода в твердых растворах, взаимное влияние их на растворимость и диффузию, резкое снижение растворимости графита в аустените под воздействием водорода, приводящее практически к полному подавлению растворения графита и аустенизации.
Однако вследствие эпизодичности исследований, их качественного характера и известных трудностей эксперимента количественных данных для построения практически важной диаграммы Fe–C–H в известной литературе не встречается. Не было также попыток расчета этой системы, а двойная диаграмма состояния Fe–H появилась совсем недавно. Построение полной диаграммы Fe–C–H – задача трудная и. безусловно, неосуществимая в одном исследовании.
Растворимость водорода исследована только до давления 100 атм., так как при более высоких давлениях у поверхности и внутри образца возникали полости, наполненные водородом и метаном, сильно искажающие результаты измерений. Проведенные эксперименты показывают, что водород монотонно снижает температуру эвтектоидного равновесия (рис. 19а), уменьшает растворимость углерода (цементита) в аустените (рис. 19б) и его эвтектоидную концентрацию (рис. 19в). соответственно смещая точки E и S на диаграмме Fe–C.
Полученные данные позволили построить участок диаграммы Fe–C–H, изотермические разрезы которого показаны на рис. 20. Диаграмма представлена для парциального давления водорода 400 атм. и вычерчена в несколько искаженных пропорциях из-за значительной разницы растворимости углерода и водорода в аустените и сдвига ими критических точек. Но, зная характер влияния водорода на положение основных критических точек (рис. 19,2), ее можно геометрически трансформировать на более низкие давления и определить координаты большинства точек. Кроме того, положение линий диаграммы при давлениях выше 100 атм. требует дальнейшего уточнения путем получения дополнительных данных о растворимости водорода при высоких давлениях.
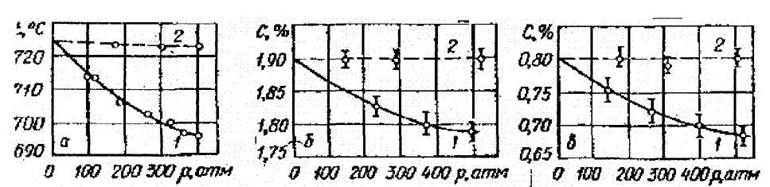
Рис. 19. Влияние водорода (1) и сжатия гелием (2) на: а – температуру эвтектоидного равновесия в системе Fe–C: б – растворимость углерода (цементита) в аустените при 1100°С, в – эвтектоидную концентрацию углерода в системе Fe–C.
Газовая фаза в системе Fe–C–H представляет собой газовый раствор метана в водороде. Равновесное парциальное давление метана при этом является функцией температуры, активности (концентрации) углерода и давления водорода.
Рис. 20. Изотермические сечения трехкомпонентной диаграммы Fe–C–H.
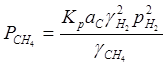
где:
aC – активность углерода в твердом α- или γ-растворе;
γH2 и γCH4 – коэффициенты фугитивности водорода и метана соответственно;
pH2 – парциальное давление водорода;
К – константа равновесия реакции С + 2Н2 → СН4.
Полученные в работе данные позволяют сделать несколько обобщений. Во-первых, в трехкомпонентной системе Fe–C–H водород ведет себя как легирующий элемент, образующий, подобно углероду, твердые растворы внедрения, и является его конкурентом. Появление водорода в твердом растворе приводит к увеличению активности углерода и выделению его в виде цементита, что снижает содержание его в растворе. Снижение концентрации компенсирует увеличение активности. Видимо поэтому, при небольших давлениях не было обнаружено влияния водорода на активность и диффузию углерода в аустените. Во-вторых, присутствие водорода увеличивает стабильность аустенита, что, в частности, подтверждает данные по системе Fe–Н. Этот вывод имеет важное значение, так как косвенные эксперименты других авторов дают противоречивые результаты. В-третьих, если водород распределен равномерно, то при небольших давлениях влиянием его как легирующего элемента можно пренебречь. Однако часто в промышленных сплавах создаются условия для локальных скоплений водорода. Это может оказать значительное влияние на формирование структуры в этих участках сплава, вызывая появление аномальных структур и специфических водородных дефектов.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.