воздействиях (температуры, давления, химически агрессивной среды и т.д.), так как процессы диффузии определяют кинетику выделения фаз, окисления, ползучести и т.д. Диффузионные процессы лежат в основе кристаллизации и рекристаллизации, фазовых превращений и насыщения поверхности сплавов другими элементами.
Имеется два подхода к проблеме изучения диффузии:
1. Феноменологический в котором металл рассматривают как континуум, т.е. пренебрегают атомной структурой металла. Здесь быть рассмотрена большая часть структурных изменений, происходящих в результате диффузионных процессов. Кинетику изменений описывают системой дифференциальных уравнений, при составлении которых используют предположения, сделанные в 1855 г. Фиком.
2. Микроскопический (атомный), в котором учитывают атомное строение и атомные процессы, связанные с диффузией.
Основные законы диффузии. Феноменологический подход основан на законах диффузии. Классическими законами диффузии считаются законы Фика, которые справедливы для слабых растворов или систем с малым перепадом диффундирующею вещества градиентом концентрации dС/dx.
Первый закон Фика: При постоянной температуре количество диффундирующего вещества dmв единицу времени через единицу поверхности dS пропорционально градиенту концентрации dC/dx и коэффициенту диффузии D(см2/с).
dm = – D (dC/dx) dSdτ
Тогда плотность потока ( в г или ат/(м2с)): j=dm/(dSdτ)
Для одномерной диффузии в направлении оси х первое уравнение Фика имеет вид: (Формулировка закона – Если градиент концентрации одного из компонентов направлен по оси х, то поток Jэтого компонента направлен в сторону уменьшения градиента концентрации и равен:)
![]()
Знак минус указывает, что диффузия
протекает в направлении, обратном вектору градиента концентрации, т. е. от
зоны с большей концентрацией к зоне с меньшей концентрацией диффундирующего
элемента. Отношение![]() называют коэффициентом диффузии.
называют коэффициентом диффузии.
Когда градиент концентрации изменяется во времени, а коэффициент диффузии принимается независящим от концентрации, процесс диффузии описывается вторым законом Фика, который выводится из первого закона:
![]()
Коэффициент диффузии D (см2/с) определяет скорость диффузии при перепаде концентрации, равном единице, зависит от состава сплава, размеров зерен и температуры и взаимодействия атомов растворимого вещ-ва с атомами растворителя.
Для определенного диапазона температур
Аррениус установил экспоненциальную зависимость коэффициента диффузии oт температуры: ![]() где D0-предэкспоненциальный
множитель (10-6-10-4 м2с), зависящий от сил
связи между атомами кристаллической решетки; Q-энергия
активации процесса диффузии (Q=150Тпл);
R-газовая постоянная, Т-абсолютная температура.
где D0-предэкспоненциальный
множитель (10-6-10-4 м2с), зависящий от сил
связи между атомами кристаллической решетки; Q-энергия
активации процесса диффузии (Q=150Тпл);
R-газовая постоянная, Т-абсолютная температура.
Атомный подход. Первое уравнение А. Фика позволяет определить суммарный поток jатомов через единицу поверхности в единицу времени между двумя соседними плоскостями кристаллической решетки, расположенными на расстоянии ∆.
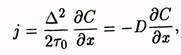 где
где ![]()
Знак минус означает, что суммарный поток jи градиент концентрации вещества dС/dx направлены противоположно, т.е. диффузия идет в сторону меньших концентраций.
Атомные механизмы диффузии.
Вопрос определения механизма диффузии является весьма сложным. Большую роль в решении этой проблемы сыграли работы Я.И. Френкеля, в которых показано огромное влияние дефектов кристаллической решетки, в особенности вакансий, на процесс диффузионного перемещения атомов. Для описания процессов диффузии или предложено несколько механизмов (обменный, циклический, межузельный, вакансионный и др.). Однако реализуется тот механизм диффузии или самодиффузии, при котором окажется наименьшей величина энергетического барьера (энергия активации Q), преодолеваемого перемещающимися атомами
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.