В большинстве случаев удобнее пользоваться потенциальной энергией взаимодействия ф(г), чем межмолекулярными силами f(r), которые связаны друг с другом соотношениями
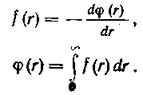
Функция ф(г) называется межмолекулярным потенциалом или просто потенциалом.
^Трактовка природы жидкостей, данная Ван-дер-Ва-альсом, безусловно оправданная в области малых давлений и высоких температур, не могла привести к успеху при объяснении их свойств при температурах,
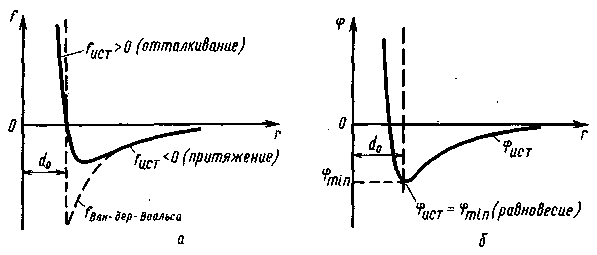
РИС. 1. Зависимость межмолекулярных сил f (а) и потенциала <р (б) от расстояния между частицами простой жидкости близких к температуре плавления. В частности, попытки дать объяснение кинетических свойств жидкостей — вязкости, диффузии, основывающиеся на представлении о том, что частицы жидкости движутся так же, как в газе, приводили к закономерностям, противоречащим экспериментальным фактам, Первые же исследования структуры жидкостей с помощью рассеяния рентгеновского излучения, проведенные при температурах, близких к температуре кристаллизации, показали, что расположение частиц в жидкостях вовсе не беспорядочно, а имеет некоторые черты сходства с их расположением в кристаллах.
В качестве дополнительного аргумента, помимо рентгеноструктурных данных в пользу близости жидкостей к кристаллическим телам вдали от критического состояния, служит тот факт, что при плавлении объем меняется всего лишь на несколько процентов, а не в несколько раз, как это бывает при испарении. Теплота перехода твердое тело — жидкость также на порядок меньше теплоты испарения.
Детальное обоснование близости жидкостей и твердых тел вблизи температуры кристаллизации было впервые проведено Я. И. Френкелем"*)[2]. Опираясь на представление о квазикристаллическбм строении жидкостей, ему удалось получить качественное описание теплового движения атомов и молекул в жидкостях, наглядно на основе решеточной модели объяснить диффузию и вязкость жидкостей, описать процессы плавления и кристаллизации.
1 ТТо Я- И. Френкелю, тепловое движение атомов или молеку4цжидкости состоит из нерегулярных колебаний вокруг положений равновесия. Эти положения равновесия не являются закрепленными на одном месте как в кристалле. Они временны и от поры до поры меняют свои координаты. В связи с большой плотностью и сильным взаимодействием частиц в жидкостях частота колебаний атомов вокруг временных неустойчивых пб-ложений равновесия близка к частоте колебаний атомов в твердом теле, а чветотаГпереекоков из одного положения равновесия в другое предполагается значительно меньше частоты" колебаний вблизи исходного или нового положения равновесия. Это позволяет понять, почему^еплЬемкость жидкостей вблизи температуры плавления мало отличается от теплоемкости исходного твердого состояния.
Сравнительно редкие перемещения частиц жидкости не могут внести существенного вклада в теплоемкость, но резко изменяют механические свойства вещества при плавлении. Если внешнее воздействие, стремящееся деформировать жидкость, прилагается к жидкости за время, меньшее оседлой жизни ее частиц т, то реакцией жидкости на такое воздействие-Ькажется ее упругая деформация, такая же как и в случае кристалла.
Это относится к любому виду деформации: растяжению, сжатию, сдвигу.
Характерное для каждой жидкости время т, в течение которого атом совершает колебания вблизи одного положения равновесия, связывается с периодом колебаний т,о уравнением
![]()
где k— постоянная Больцмана; Т— температура, К;
е — энергия активации, необходимая атому для преодоления потенциального барьера, разделяющего два возможных положения равновесия]
Средний период колебаний атомов вблизи положения равновесия to по порядку величины равен 10~12—10~13 с. Время т между двумя перескоками от одного положения равновесия к другому зависит от температуры и еще от величины б, т. е. от природы жидкости, ее строения, энергии межчастичного взаимодействия, но оно всегда больше to. Для одноатомных жидкостей величина т равна 10~и с.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.