РАСКИСЛЕНИЕ И ЛЕГИРОВАНИЕ СТАЛИ
§ 1. Способы раскисления
Технологический период, предназначенный для снижения активности кислорода до заданных пределов, является периодом раскисления стали. Раскисленный металл при разливке и кристаллизации не кипит, из него не выделяются газы, его называют спокойным. В том случае, когда проводят неполное раскисление и в нем остается значительная доля избыточного кислорода, то в стали при ее охлаждении во время разливки и после нее до кристаллизации протекает взаимодействие между растворенными углеродом и кислородом по схеме: [С] + [O] = {СО}. Пузыри монооксида углерода, выделяющиеся из металла перемешивают его. Поверхность металла становится похожей на поверхность кипящей жидкости. Такую сталь называют кипящей.
Если при раскислении из металла удаляют значительную часть избыточного кислорода, то оставшийся кислород вызывает непродолжительное кипение стали. Такую сталь называют полу спокойной.
Обычно раскисление кипящей стали осуществляют введением сравнительно небольших количеств марганца, понижающего содержание кислорода в металле до пределов несколько более высоких по сравнению с равновесным по углероду. Иногда кроме марганца (до 0,3—0,4 %) в металл вводят незначительные количества алюминия. При раскислении полуспокойной стали снижение степени окисленности металла проводят до уровня, соответствующего равновесному с углеродом. При этом кроме марганца (до 0,4 - 0,5 %) в металл вводят некоторое количество кремния (до 0,08 - 0,12 %). Раскисление спокойной стали ведут до степени окисленности металла значительно более низкой, чем это соответствует равновесию с углеродом. Снижение активности кислорода в металле проводят либо снижением его содержания, либо связыванием в прочные соединения. Существуют различные способы раскисления: осаждающее, диффузионное, обработка синтетическим шлаком или в вакууме. Наиболее распространенным является первый способ: так как степень окисленности шлака чаще всего выше, чем металла.
При осаждающем раскислении раскислитель вводят непосредственно в металл, поэтому взаимодействие элемента-раскислителя с кислородом происходит в объеме расплава по реакции: n [О] + m[Me] = <MemOn>*, константу равновесия которой можно представить в виде:

Продукты раскисления образуются в жидком металле в виде тонкодисперсных включений. Поскольку концентрация кислорода и раскислителя в металле невелики, выражение (92) можно упростить:
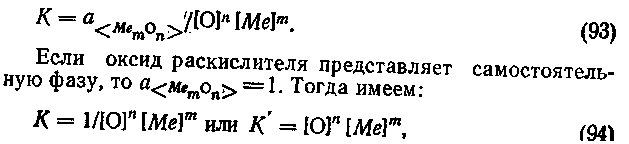
Значения произведения равновесных концентраций [О] и [Me] используют для сопоставления раскислительной способности элементов. В логарифмических координатах (так как lgK|=nlg[O]+mlg[Me]) для некоторых раскислителей такое сопоставление представлено на рис. 51.
В дуговых электропечах перед раскислением восстановительная атмосфера создается углеродом электродов. Раскисление проводят под карбидными или белыми шлаками введением в них раскислителей. При этом раскисляют шлак,
* Остроугольными скобками обозначен оксид раскислителя, находящийся в жидком металле в твердом состоянии.
а кислород из металла в результате диффузии переходит в шлак. Эта стадия процесса является самой медленной, поэтому такой способ раскисления называют диффузионным. Преимуществом диффузионного раскисления перед осаждающим является то, что продукты взаимодействия кислорода и раскислителя остаются в шлаке и не загрязняют металл.
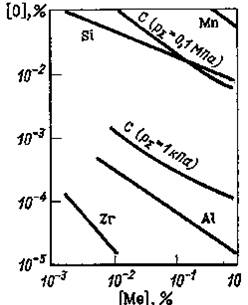
Рис. 51. Раскислительная способность некоторых элементов при 1600 °С
Раскислительную способность элемента выражают остаточной равновесной концентрацией кислорода при заданной температуре с определенным содержанием в металле раскислителя. Для количественной сравнительной оценки принимают содержание элемента, равным 1 %, при 1600 °С. При более сильных раскислителях равновесное содержание кислорода в металле при прочих равных условиях всегда меньше чем для слабых. Наиболее высокой раскислительной способностью обладают комплексные раскислители, при использовании которых образуются легко удаляемые продукты раскисления. В сплавах относящихся к комплексным раскислителям могут содержаться кремний, алюминий, кальций, магний и другие элементы. Более легкому удалению продуктов раскисления способствует получение их (при использовании комплексных раскислителей) в жидком состоянии. Углеродное раскисление в условиях вакууму способствует существенному снижению содержания кислорода в металле без образования неметаллических включений в связи со смещением равновесия по реакции (72) сторону образования монооксида углерода, пузыри которого сравнительно легко удаляются из жидкого металла. В условиях вакуума раскислительная способность углерод; может оказаться выше, чем, например, кремния и алюминия. При практически неизменной активности углерода ( а[С] = const) активность кислорода тем ниже, чем ниже давление атмосферы над раскисляемым металлом. J
В современных вакуумных установках, применяемых в металлургии, достигается давление до 100 Па. Это в ряде случаев позволяет раскислить сталь углеродом до глубоких пределов, не расходуя больших количеств других раскислителей. Раскисление металла обработкой стали синтетическими шлаками, не, содержащими оксидов железа, осуществляется в результате снижения активности кислорода в металле при постоянных температуре и коэффициенте распределения кислорода lо, что видно из выражежния:
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.