30. Предполагая (следуя Demicheli), что механизм каталитического разложения метана описывается уравнениями 1-7 (см. ниже). Считая, что лимитирующей стадией является первая стадия (скорость стадии определяется кинетическими закономерностями), что все свободные центры заняты преимущественно водородом, а все остальные стадии находятся в равновесии, установить формулу для скорости разложения метана.
Решение:
1). CH4 + n S ↔ CH4Sn k1, k-1 лимитирующая стадия (I гипотеза)
2). CH4Sn ↔ CH3Sn-1 + HS K2 центры заняты в основном
3). CH3Sn-1 ↔ CH2Sn-2 + HS K3 водородом (II гипотеза)
4). CH2Sn-2 ↔ CHSn-3 + HS K4 Все
5). CHSn-3 ↔ CSn-4 + HS K5
6). CSn-4 ↔ C + (n-4) S K6
7). HS ↔ ½ H2 + S K7 = 1/KH
KH – константа хемосорбции водорода.
1). ![]()
2). 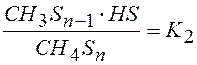
3). 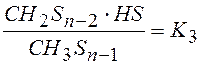
4). 
5). 
6). 
7). 
Перемножая уравнения (2 – 6) =>

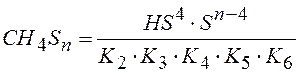
Подставляем в (1).

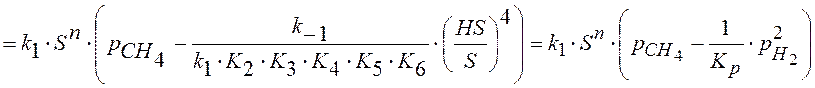

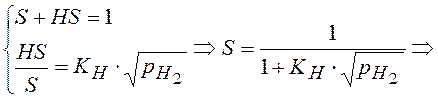
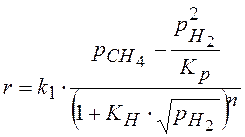
Что изменится, если предположить, что лимитирующая стадия- это стадия 2?
31. Получить соотношение для скорости реакции каталитического разложения метана в предположении следующего механизма реакции:
1). CH4 + S ↔ CH4S K1
2). CH4S + S ↔ CH3S + HS k2, k -2 лимитирующая стадия (I гипотеза)
3). CH3S +S ↔ CH2S + HS K3 занятые центры заняты в основном
4). CH2S + S ↔ CHS + HS K4 водородом (II гипотеза)
5). CHS + S ↔ CS + HS K5
6). CS ↔ C + S K6
7). HS = ½ H2 + S K7 = 1/KH
32. Получить соотношение для скорости реакции каталитического разложения метана, принимая следующий механизм реакции (схема Alstrup):
1). CH4 + 2S = CH3S + HS k1, k-1 лимитирующая стадия (I гипотеза)
2). CH3S + S = CH2S + HS K2 центры заняты в основном
3). CH2S +S = CHS + HS K3 водородом (II гипотеза)
4). CHS + S = CS + HS K4
5). CS = C + S K5
6). HS = ½ H2 + S K6 = 1/KH
33. Получить соотношение для скорости реакции каталитического разложения метана в предположении следующего механизма реакции:
1). CH4 + 3S = CH4S3 k1, k-1 лимитирующая стадия (I гипотеза)
2). CH4S3 + S = CH3S3 + HS K2
3). CH3S3 +S = CH2S3 + HS K3
4). CH2S3 + S = CHS3 + HS K4
5). CHS3 + S = CS3 + HS K5
6). CS3 = C + S3 K6
7). HS = ½ H2 + S K7 = 1/KH
Расчет изотермических реакторов
34. Определите объем проточного реактора
идеального перемешивания, необходимый для достижения степени превращения
исходного реагента x1 = 0,85 при проведении простой реакции 2А1![]() A2+A3, если c10 = 2,5 кмоль/м3, k = 18,2 м3/(кмоль×ч), реагенты подают в реактор с
объемным расходом F
= 1,2 м3/ч.
A2+A3, если c10 = 2,5 кмоль/м3, k = 18,2 м3/(кмоль×ч), реагенты подают в реактор с
объемным расходом F
= 1,2 м3/ч.
35. Определите степень превращения реагентов А1 и А2 на выходе из проточного реактора идеального перемешивания объемом 0,5 м3 при проведении простой реакции A1+А2 ® А3+А4, если с10 = 1,2 кмоль/м3, с20 = 1,6 кмоль/м3, объемный расход F = 5 м3/ч, константа скорости k = 12 м3/(кмоль×ч).
36. В проточном реакторе идеального перемешивания
проводят простую реакцию 2A1 ® A2+A3,
протекающую в газовой фазе при температуре 800 К и давлении 6×105 Па. В реактор подают
смесь, объемная доля реагента А1 в которой составляет 70%, а
объемная доля инертного компонента – 30%. Определите среднее время пребывания ![]() , необходимое для достижения степени
превращения X1 = 0,8, если константа скорости k = 414,7 м3/(кмоль×ч).
, необходимое для достижения степени
превращения X1 = 0,8, если константа скорости k = 414,7 м3/(кмоль×ч).
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.