Температура адиабатического разогрева реактора (![]() ) – это температура
разогрева реакционной среды (реактора) в отсутствии теплообмена с внешней
средой в случае полного превращения реагентов. Если имеется только одна реакция
) – это температура
разогрева реакционной среды (реактора) в отсутствии теплообмена с внешней
средой в случае полного превращения реагентов. Если имеется только одна реакция
![]() , то (5.9) для адиабатического случая принимает вид
, то (5.9) для адиабатического случая принимает вид
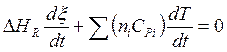 или
или  , (5.13)
, (5.13)
откуда, если правая часть
слабо зависит от Т и ![]() ,
,
![]() . (5.14)
. (5.14)
В случае полного
превращения ![]() и, следовательно,
и, следовательно,
![]() . (5.15)
. (5.15)
5.2 Некоторые решения для изотермического реактора (T(t)= const)
В этом случае уравнение энергии исключается и решаются только уравнения баланса массы. Рассмотрим несколько типов реакций.
5.2.1 Обратимая реакция второго порядка, dT/dt = 0, dV/dt = 0
Пусть имеем одну обратимую реакцию второго порядка
![]() . (5.16)
. (5.16)
Пусть (5.16) – это реакция 1-го порядка по каждому компоненту,
общий порядок – 2-й. При этом в общем случае закон действующих масс может не
соблюдаться и для реакции первого порядка по каждому компоненту стехиометрические
коэффициенты мoгут
быть отличными от ![]() .
.
В этом случае в соответствии с (3.11) скорость реакции (5.16)
 , (5.17)
, (5.17)
где 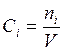 ;
; ![]() ;
; ![]() .
.
Подставляя в (5.8) r из (5.17) и учитывая, что согласно определению
(2.4)  , а значит,
, а значит,
![]() ,
, ![]() ;
;
![]() ,
, ![]() . (5.18)
. (5.18)
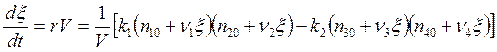 . (5.19)
. (5.19)
Проводя далее
интегрирование при условии ![]() :
: ![]() ,
, ![]() :
: ![]() получим
получим
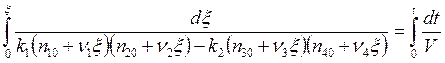 , (5.20)
, (5.20)
откуда можно получить
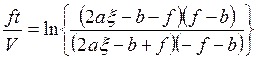 , (5.21)
, (5.21)
где ![]() ;
; ![]() ;
; ![]() ;
; ![]() .
.
В соответствии с (2.8) степень превращения 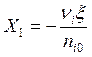 .
.
Селективность в данном случае ![]() по
любым реагентам, так как имеет место единственная реакция.
по
любым реагентам, так как имеет место единственная реакция.
В случае простой реакции (5.16) (выполняется закон действующих
масс ![]() ,
, ![]() ). При
этих значениях
). При
этих значениях ![]() ,
, ![]() ,
, ![]() ,
, ![]() соотношение (5.21) совпадает с соотношением, приведенным в
табл. 5.1.
соотношение (5.21) совпадает с соотношением, приведенным в
табл. 5.1.
5.2.2 Две последовательные реакции 1-го порядка (dT/dt = 0)
j= 1: ![]() ,
, ![]() и j = 2:
и j = 2: ![]() ,
, ![]() .
.
Будем полагать, что закон
действия масс может не выполняться, т.е. ![]() -
произвольные.
-
произвольные.
В соответствии с (2.6) ![]() , следовательно,
, следовательно,
![]() ;
; ![]() ;
; ![]() . (5.22)
. (5.22)
Подставляя ![]() , и (5.22) в (5.8) и учитывая, что
, и (5.22) в (5.8) и учитывая, что ![]()
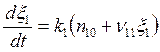 ; (5.23)
; (5.23)
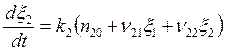 ; (5.24)
; (5.24)
![]() ,
, ![]() (или
(или ![]() ,
, ![]() ). (5.25)
). (5.25)
Интегрируя (5.23) и подставляя ![]() в
(5.24), получим
в
(5.24), получим
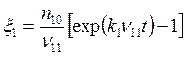 ; (5.26)
; (5.26)
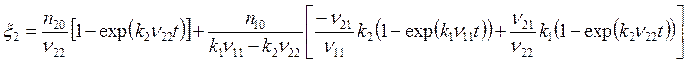 . (5.27)
. (5.27)
Степень превращения  , так как в
соответствии с (2.8)
, так как в
соответствии с (2.8)  (j = 1, 2).
(j = 1, 2).
Вычисление селективности и выхода. Пусть целевой продукт - А2.
В соответствии с определением (2.15) мгновенная селективность
 . (5.28)
. (5.28)
Отсюда, после подстановки dn2 и dn1, полученных из (5.22),
 .
.
Или с учетом (5.23), (5.24)
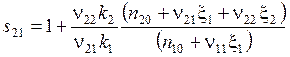 , (5.29)
, (5.29)
где ξ1 и ξ2 - из уравнений (5.26), (5.27).
Интегральная селективность в соответствии с (2.10) и (2.18)
![]() . (5.30)
. (5.30)
Выход
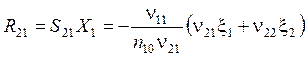 . (5.31)
. (5.31)
Из (5.31) в случае n20=0 (вещество A2 в начальный момент в реакторе отсутствует) можно получить
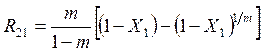 , (5.32)
, (5.32)
где ![]() .
.
Из (5.32) видно, что выход R21 в рассматриваемом случае
является экстремальной функцией от степени превращения Х1. Из
условия ![]() можно найти, что максимальный выход и
соответствующее ему значение степени превращения определяются соотношениями
можно найти, что максимальный выход и
соответствующее ему значение степени превращения определяются соотношениями
![]() ;
; ![]() . (5.33)
. (5.33)
С увеличением m (увеличение скорости
превращения А1) ![]() возрастает.
возрастает.
Решение для некоторых других типов реакций (Т = const) представлены в таблице 5.1.
Таблица 5.1.
|
Схема реакции |
Кинетическое соотношение |
Порядок реакции |
Уравнения баланса массы |
|
|
Дифференциальное |
Интегральное |
|||
|
|
|
0 |
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
2 ( |
|
|
|
|
|
2 |
|
где
|
|
|
|
1 |
|
|
|
|
|
1 |
|
|
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.