Суммарная скорость реакции в порах катализатора может зависеть от процесса диффузии исходных реагентов и продуктов реакции в порах. Фактически, увеличение скорости изменения содержания реагирующих веществ в реакторе не должно происходить пропорционально увеличению удельной поверхности гранул. По этой причине проблема приготовления катализаторов оптимальной текстуры должна решаться на основе рассмотрения транспорта реактантов и продуктов реакции в порах.
Рассмотрим эту проблему в идеальном случае каталитической реакции, протекающей в сферическом пористом зерне гомогенной структуры, то есть с активными местами равномерно распределенными по объему зерна. На рис. 1.1 изображена гранула радиусом R и типичный профиль концентрации реагирующего вещества внутри нее. Выделим сферический слой dz, и рассмотрим баланс массы для этого слоя.
Пусть гранула радиусом R погружена в газообразную или жидкую среду, содержащую реактант А1, который в контакте с катализатором участвует в реакции
n1A1+n2A2=0, r'=kMC1
Это реакция первого порядка, где r' выражается в моль/сек (кг катализатора) (в этих условиях, константа скорости реакции km выражается в m3/с (кг катализатора)). Вводя эффективный коэффициент диффузии De, мы можем использовать выражение подобное закону Фика, чтобы записать уравнение баланса для сферического слоя толщиной dz в результате реакции и расход вещества через сферическую поверхность радиусом z+dz.
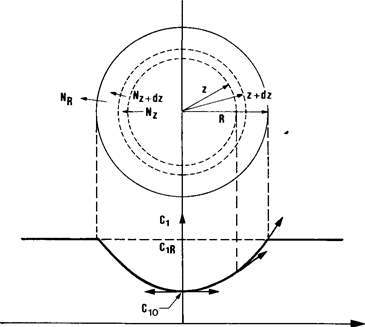
Рис. 1.1 Диффузионные потоки в сферическом слое гранулы катализатора и типичный концентрационный профиль в грануле.
В соответствии с рис.1.1 поток вещества через поверхность радиуса z в единицу времени:
 (1.12)
(1.12)
Количество вещества, образующегося (исчезающего) в единицу времени внутри слоя:
![]() (1.13)
(1.13)
поток вещества через поверхность радиуса z+dz в единицу времени
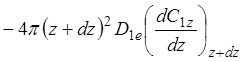 (1.14)
(1.14)
Складывая, преобразуя и упрощая, баланс можно записать в виде:
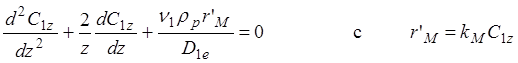 (1.15)
(1.15)
Это дифференциальное уравнение может быть решено с использованием следующих граничных условий
![]() (1.16)
(1.16)
 (из условий симметрии) (1.17)
(из условий симметрии) (1.17)
где С1R – концентрация вещества А1 на внешней поверхности гранулы.
Делая замену переменой y=zC1z, можно записать:
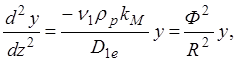 (1.18)
(1.18)
где
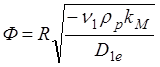 (1.19)
(1.19)
Общее решение (1.18) можно получить в виде:
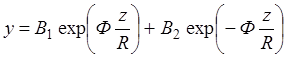 (1.20)
(1.20)
Граничные условия перепишутся в виде:
для z = 0 y = 0 следовательно В1 = - В2
для z = R y = RC1R (1.21)
При этом имеем:
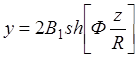 (1.22)
(1.22)
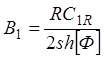 (1.23)
(1.23)
Ф, определяемая (1.19) – безразмерное число, называемое модулем Тиле. Его можно записать также в виде:
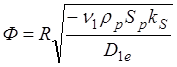 (1.24)
(1.24)
Окончательно решение (1.15):
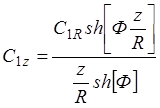 (1.25)
(1.25)
Разлагая sh [z/R] в ряд в окрестности точки z = 0, получим:
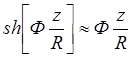 (1.26)
(1.26)
Подставляя (1.26) в (1.25), можно получить
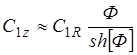 (1.27)
(1.27)
Дифференцируя (1.25) получим:
 (1.28)
(1.28)
Это выражение всегда >0.
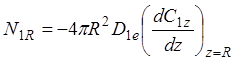 (1.29)
(1.29)
Подставляя в (1.29) dC1z/dz при z = R из (1.28) ®
 (1.30)
(1.30)
или
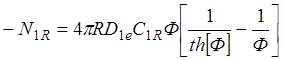 (1.31)
(1.31)
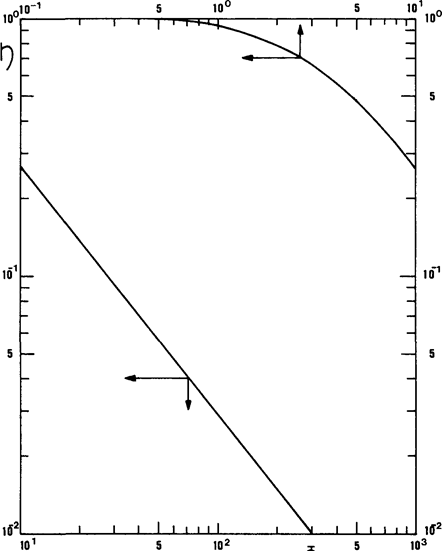
Рис. 1.2 Соотношение между эффективностью и модулем Тиле.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.