






















МЕТОДИЧЕСКИЕ УКАЗАНИЯ К ВЫПОЛНЕНИЮ ДОМАШНИХ ЗАДАНИЙ ПО МОЛЕКУЛЯРНОЙ ФИЗИКЕ
1. Уравнение состояния идеального газа (уравнение Клайперона-Менделеева)
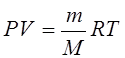 |
R=8.31 Дж/моль*К – молярная (универсальная) газовая постоянная.
2. Закон Дальтона. Давление смеси газов равно сумме парциальных давлений Pi газов, составляющих смесь:
![]()
3. Масса киломоля смеси газов, состоящей из n компонентов, определяется по формуле:
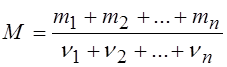 |
где mi – масса i-го газа, ni – количество вещества (в молях i-го газа, находящегося в смеси
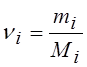 |
4. Барометрическая формула, выражающая убывание давления газов с высотой h над поверхностью Земли
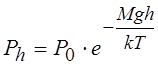 |
Где P0 – давление на высоте h=0, g – ускорение свободного падения.
5. Основное уравнение кинетической теории газов:
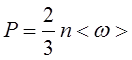 |
Где n – концентрация молекул,
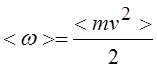 |
Для однородного по составу газа
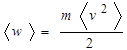
Где
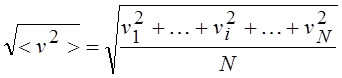 |
Средняя квадратичная скорость;
Здесь vi – скорость i-ой частицы, N – число частиц.
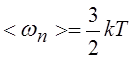 |
Где K – постоянная Больцмана
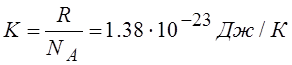 |
NA – число молекул , содержащихся в одном моле вещества, моль-1 (число Авогадро).
6. Зависимость давления от концентрации молекул и температуры газа:
P=nkT
7. Числом степеней свободы i называется число независимых координат, с помощью которых может быть задано положение тела или частицы в пространстве.
Средняя кинетическая энергия, приходящаяся на одну степень свободы:
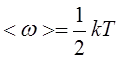 |
8. Средняя энергия одной молекулы, имеющей i степеней свободы:
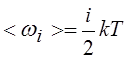 |
Для молекул одноатомного газа i = 3, двухатомного i = 5, трех- и более атомных газов i = 6, если не возбуждены колебательные степени свободы.
9. Распределение молекул по скоростям (закон Максвелла): число молекул DN, относительные скорости которых лежат в интервале от U до U+DU равно
DN=N0f(U)DU
Здесь N0 – полное число молекул газа.
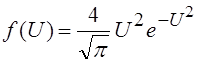 |
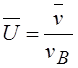 |
где v – данная скорость, vв – наиболее вероятная скорость. Характерные скорости молекул газа вычисляются по формулам:
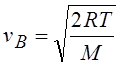 |
Наиболее вероятная;
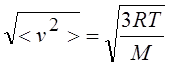 |
Средняя квадратичная;
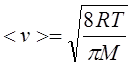 |
Средняя арифметическая.
10.Cреднее число столкновений, испытываемых одной молекулой за секунду:
Где ps2 – эффективная площадь сечения молекулы, n – концентрация молекул газа.
11.Средняя длина свободного пробега молекул газа:
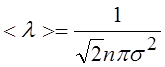 |
12.Первое начало термодинамики:
Q=DE+A
Количество теплоты Q, сообщенное системе, идет на изменение ее энергии DE и совершение силами давления системы работы над окружающей средой.
13.Внутренняя энергия одного моля идеального газа:
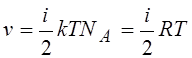 |
14.Молярная теплоемкость измеряется количеством теплоты, необходимой для нагревания одного моля вещества на 1К:
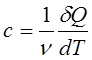 |
15.Молярная теплоемкость смеси газов, состоящей из n компонентов:
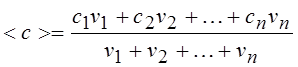 |
16.Удельная теплоемкость измеряется количеством теплоты, необходимым для нагревания единицы массы вещества на 1К:
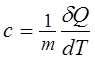 |
17.Удельная теплоемкость смеси газов, состоящей из n компонентов:
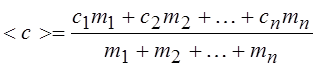 |
18.Связь между удельной и молярной теплоемкостью:
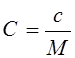 |
19.Молярная теплоемкость идеального газа при постоянном объеме:
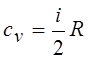 |
20.Молярная теплоемкость идеального газа при постоянном давлении:
21.Внутренняя энергия идеального газа:
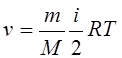 |
22.При элементарном изменении объема газа силами давления совершается работа:
dA=PdV
23.Работа сил давления газа при изобарическом изменении его объема
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.