Пример: Какое количество газа пропана (m,n, V) можно сжечь, затратив1 кг кислорода? Какой объём жидкой воды при этом получится? Плотность воды 1г/мл.
 Дано: Решение:
Дано: Решение:
m(О2) = 1 кг С3Н8 + 5 О2 = 3СО2 + 4Н2О(ж).
М(О2) = 32г/моль 44г(С3Н8) – 5´32г(О2) - 4´18г(Н2О)
М(С3Н8) = 44г/моль х г(С3Н8) –1000г(О2) – у г(Н2О)
М(Н2О) =
18г/моль 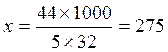 г(С3Н8);
г(С3Н8);
r(Н2О) = 1г/мл n((С3Н8)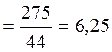 моль
моль
V(С3Н8)= 6,25моль´22,4л/моль = 140л (С3Н8)
m(С3Н8) = ? =
275г 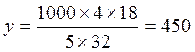 г (Н2О(ж))
г (Н2О(ж))
n(С3Н8) =? =6,25 моль V(Н2О(ж))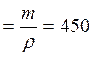 г/1(г/мл) = 450мл
г/1(г/мл) = 450мл
V(С3Н8) = ? = 140 л
V (H2O) =? 450 мл
В т о р о й с п о с о б р а с ч е т а:
1) Заданное количество реагента (здесь: кислорода) пересчитывается на число моль:
n(O2) = 1000(г)/32(г/моль) = 31,25 моль.
2) Вычисляются количества моль остальных участников реакции:
1 моль (С3Н8) – 5 моль (О2) – 4 моль (Н2О)
х моль (С3Н8) –31,25 моль (О2) – у моль (Н2О)
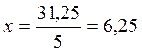 моль (С3Н8);
моль (С3Н8);
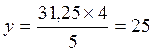 моль (Н2О).
моль (Н2О).
3) Числа моль каждого участника реакции пересчитываются на другие (требуемые условием задачи) способы измерения количества вещества:
m(С3Н8) = 6,25(моль)´44(г/моль) = 275[г]
m (H2O) = 25моль ´18 (г/моль) = 450 [г ]
V(С3Н8) = 6,25(моль) ´ 22,4 (л/моль) = 140[л ]
V (H2O(ж)) = 450(г)/1(г/мл) = 450 [мл ]
Один из способов постановки условия – задание количеств обоих реагентов. В этом случае полностью расходуется тот реагент, который взят
в н е д о с т а т к е. Именно его количество является основой расчёта по уравнению реакции.
Для определения вида реагента, взятого в недостатке (или в избытке), достаточно сопоставить количества моль каждого реагента, приходящиеся на единицу его коэффициента в уравнении реакции.
Пример: Смешали 10 г этана и 30 г О2. Сколько СО2 (m, V) получится в результате реакции?
![]() Дано: Решение:
Дано: Решение:
1) m(C2 H6 ) = 10 г На первый взгляд кислород взят в избытке по
2) М(С2Н6) = 30г/моль сравнению с этаном (30 г и 10 г соответственно).
3) m(О2) = 10 г Однако, использование коэффициентов уравнения
4) М(О2) = 32г/моль реакции горения этана показывает, что это не так.
5) М(CO2) = 44г/моль 2С2Н6 + 7 О2 = 4СО2 + 6Н2О(ж).
![]()
m(СO2) = ? = 3,37г (а) Исходные количества вещества реагентов:
V(CO2) = ? =
1,725л n(С2Н6)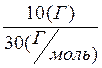 =0,33(моль);
=0,33(моль);
n(O2) = 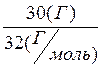 =
0,94 (моль).
=
0,94 (моль).
б) Количество вещества реагентов в расчете на единицу коэффициента в уравнении реакции:
nI
(С2Н6) ![]() =0,167(моль); nI
(O2)
=0,167(моль); nI
(O2) ![]() =0,134(моль);
=0,134(моль);
Из сопоставления полученных величин следует, что в недостатке взят О2, а С2Н6 – в избытке; рассчёт количества получающихся продуктов реакции нужно вести по кислороду.
(в) Вычисляем количество получаемого СО2:
7моль О2 – 4 моль СО2
0,134 моль О2 – х моль СО2
Х =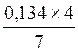 = 0,077 моль (СО2);
= 0,077 моль (СО2);
m(СO2)
= 0,0077 (моль) ![]() 44 (г/моль) = 3,37 [г];
44 (г/моль) = 3,37 [г];
V(CO2)
= 0,0077 (моль) ![]() 22,4 (л/моль) = 1,725 [л].
22,4 (л/моль) = 1,725 [л].
(Для проверки можно сделать два расчёта и убедиться, что
(а) 10 г С2Н6 требуют для сжигания 37,3 г О2 – а взято 30 г О2;
(б) затратив 30 г О2 можно сжечь 8, 03 г С2Н6, - т.е. 10 г С2Н6 – избыток).
1) Технические вещества, как правило, содержат примеси других веществ. Это означает, что реагирует только часть массы технического вещества за вычетом массы примесей, - собственно реагент, количество которого и берется в расчет по уравнению реакции.
2) В ходе органических реакций, обычно, кроме основного продукта, получаются побочные, на образование которых затрачивается часть реагентов. Следрвательно, количество практически получаемого основного продукта – меньше, чем должно теоретически получиться по закону сохранения массы.
В уравнении реакции показаны только исходные реагенты и основные продукты. Рассчитанное поэтому уравнению реакции количество продукта называется теоретическим. Доля практически полученного продукта от теоретически расчитанного называется выход реакции (выражается в долях от единицы или в процентах).
 Пример: На хлорирование этана
затратили 40 г технического хлора, содержащего 8 % (по массе) примесей, и
получили 16,6 г дихлорэтана. Каков выход продукта?
Пример: На хлорирование этана
затратили 40 г технического хлора, содержащего 8 % (по массе) примесей, и
получили 16,6 г дихлорэтана. Каков выход продукта?
Дано: Р е ш е н и е
![]() = 16,6 г С2Н6 + 2Cl2
= C2H4Cl2 + 2HCl
= 16,6 г С2Н6 + 2Cl2
= C2H4Cl2 + 2HCl
M(C2H4Cl2) = 99 г/моль (а) Масса примесей в техн. хлоре
m(Cl2)(техн.) =
40 г m(прим.) = 40![]() 0,08 =3.2 г
0,08 =3.2 г
w(прим.) = 8% (б) В реакцию вступило хлора:
M(Cl2) = 71г/моль m(Cl2) = 40 -3,2 =36.8 [г]
w = ? =
64% (в) 2 ![]() 71 г Cl2 – 99 г C2H4Cl2
71 г Cl2 – 99 г C2H4Cl2
36,8 г Cl2 - X г C2H4Cl2
X = 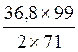 =
25,66 г (С2Н4Сl2) – теоретически
должно получиться
=
25,66 г (С2Н4Сl2) – теоретически
должно получиться
(г) Определяем выход по реакции:
w(выход) = 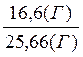 = 0,647 или 64,7%.
= 0,647 или 64,7%.
Примечание: Не путать % примеси в газе
(а) по массе и (б) по объёму!
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.