Напишите уравнения диссоциации на ионы следующих веществ: KHSO3; HMnO4; Cr2(SO4)3; КН2РО4; А1(ОН)2С1; Ва(ОН)2; Zn(OH)2.
4 Напишите выражение константы диссоциации сероводородной кислоты по первой и второй ступеням.
5 Что нужно сделать, чтобы понизить степень диссоциации сероводородной кислоты? Изменится ли при этом константа диссоциации?
6 На основании сравнения констант диссоциации определите, какая кислота сильнее − сероводородная или угольная, синильная или уксусная?
7 Напишите следующие реакции в молекулярном, полном ионном и сокращенном ионном видах:
a) ZnS + HCI →
б) Li2CO3 + HNO3 →
в) Cr(OH)3 + NaOH →
г) Сr(ОН)3 + H2SO4 →
д) Na2CO3 + ZnCI2 →
8 Как доказать, что гидроксид олова (II) обладает амфотерными свойствами, а гидроксид магния − нет?
Лабораторная работа № 2
Гидролиз солей
Краткие сведения из теории
Обменная реакция между водой и
химическим соединением называется его гидролизом. В результате протекания процесса
гидролиза соли в растворе появляется некоторое избыточное количество ионов ![]() или
или ![]() ,
сообщающее раствору кислотные или основные свойства. Таким образом, процесс
гидролиза соли обратен процессу нейтрализации, т. е. процессу взаимодействия
кислот с основаниями.
,
сообщающее раствору кислотные или основные свойства. Таким образом, процесс
гидролиза соли обратен процессу нейтрализации, т. е. процессу взаимодействия
кислот с основаниями.
Гидролиз солей можно упрощенно представить следующими схемами:
![]()
![]()
где ![]() – катион,
– катион, ![]() – анион.
– анион.
Гидролиз приводит
к образованию малодиссоциирующих кислот, оснований, кислых или основных солей.
Тип реакции гидролиза зависит, прежде всего, от химической природы катионов и
анионов, образующих соли, и их поляризующего действия на молекулы воды,
зависящего от заряда и радиуса ионов. Чем больше заряд и меньше радиус ионов
соли, тем сильнее их электростатическое и поляризационное взаимодействие с
водой, слабее диссоциация образующихся частиц ![]() ) и
) и ![]() и в большей степени происходит гидролиз.
и в большей степени происходит гидролиз.
Влияние на
молекулы воды невелико у катионов щелочных и щелочноземельных металлов,
однозарядных анионов, например ![]() ,
, ![]() ,
, ![]() , у некоторых двухзарядных, например
, у некоторых двухзарядных, например ![]() , т.е. соли, образованные анионом
сильной кислоты и катионом сильного основания, гидролизу не подвергаются,
например KCl, NaNO3.
, т.е. соли, образованные анионом
сильной кислоты и катионом сильного основания, гидролизу не подвергаются,
например KCl, NaNO3.
Гидролизу подвергается не вся соль в растворе. Отношение числа гидролизованных молекул соли к общему числу растворенных молекул называется степенью гидролиза h:
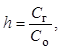
где ![]() –
концентрация гидролизованной части соли;
–
концентрация гидролизованной части соли;
![]() – общая концентрация
растворенной соли.
– общая концентрация
растворенной соли.
Процесс гидролиза является обратимым. В растворе соли, подвергшейся гидролизу, устанавливается равновесие между солью и продуктами гидролиза:
![]()
Этому равновесию соответствует константа
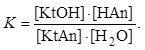
Так как
концентрация воды в разбавленных растворах солей является практически
постоянной величиной, то ![]() , где величина
, где величина ![]() называется константой гидролиза соли:
называется константой гидролиза соли:
![]()
Значение ![]() определяет способность данной соли
подвергаться гидролизу: чем больше
определяет способность данной соли
подвергаться гидролизу: чем больше ![]() , тем больше степень
гидролиза соли.
, тем больше степень
гидролиза соли.
В величине ![]() проявляется природа соли: чем слабее
кислота (основание), тем больше степень гидролиза ее соли, так как константа
гидролиза соли
проявляется природа соли: чем слабее
кислота (основание), тем больше степень гидролиза ее соли, так как константа
гидролиза соли ![]() связана с константой диссоциации
кислоты
связана с константой диссоциации
кислоты ![]() (константой диссоциации основания
(константой диссоциации основания ![]() ) зависимостью
) зависимостью
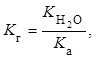
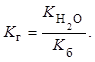
На состояние
равновесия между солью и продуктами гидролиза ![]() влияет
концентрация каждого из участвующих в реакции веществ и температура. При
уменьшении концентрации соли путем разбавления раствора увеличивается
относительная концентрация молекул воды, и по принципу Ле Шателье равновесие
реакции гидролиза смещается в сторону образования продуктов гидролиза, т. е.
степень гидролиза соли увеличивается.
влияет
концентрация каждого из участвующих в реакции веществ и температура. При
уменьшении концентрации соли путем разбавления раствора увеличивается
относительная концентрация молекул воды, и по принципу Ле Шателье равновесие
реакции гидролиза смещается в сторону образования продуктов гидролиза, т. е.
степень гидролиза соли увеличивается.
Реакция гидролиза протекает с поглощением теплоты (эндотермическая реакция). Поэтому при повышении температуры по принципу Ле Шателье равновесие реакции гидролиза также смещается в сторону образования продуктов гидролиза, т. е. степень гидролиза соли увеличивается.
Итак, для уменьшения степени гидролиза растворы солей следует хранить концентрированными и при низких температурах.
Возможны следующие случаи гидролиза солей: гидролиз по аниону, по катиону и аниону одновременно.
Гидролиз по аниону. Ему подвергаются соли, образованные катионом сильного основания и анионом слабой кислоты (K2CO3, Na2S, Na2SO3, K3PO4 и др.). При гидролизе создается щелочная среда (рН > 7). Например:
![]()
![]() реакция не
идет;
реакция не
идет;
![]()
Молекулярное уравнение гидролиза –
![]()
Как видно,
гидролизу подвергается анион слабой кислоты ![]() ,
входящий в состав соли, и реакция сопровождается образованием малодиссоциированных
молекул уксусной кислоты CH3COOH и ионов
,
входящий в состав соли, и реакция сопровождается образованием малодиссоциированных
молекул уксусной кислоты CH3COOH и ионов
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.