














1. ТЕХНИКО-ЭКОНОМИЧЕСКОЕ ОБОСНОВАНИЕ
1.1. Экономико-географическая характеристика
Завод ОАО «Кока-Кола Владивосток Боттлерс» расположен в пригороде Владивостока. На заводе выпускают большой ассортимент безолкагольных напитков различных объемов:
§ Кока-Кола (ваниль, лайт),
§ Фанта (с апельсиновым соком, вкус диких ягод, со вкусом ананаса),
§ Бон Аква (сильно газированная и слабо газированная),
§ Фрукт Тайм (дюшес, Буратино, лимонад).
Эти напитки пользуются высокой популярностью во многих городах России. В летний период производительность завода возрастает в несколько раз так, как спрос на напитки увеличивается.
Для производства напитков основным сырьем является вода, поэтому к ней предъявляются особые требования. Каждые 4 часа оператор водоподготовки обязан проверять состояние воды на содержание в ней свободного хлора, проверять мутность, рН, следить за взвешенным слоем шлама в реакторе. Если слой шлама попадет в трубу смешивания, то насосами эта вода будет подаваться на песочные фильтры, что приведет к их сильному загрязнению и не пригодности до того времени пока не будет произведена замена песка. Поэтому на операторе водоподготовки лежит очень большая ответственность и от него зависит качество выпускаемой продукции.
Требование к качеству природной питьевой воде.
При приготовлении безалкогольных и слабоалкогольных напитков вода является технологическим сырьем. В напитках ее содержится 90-95 %. Кроме того, вода используется для мойки оборудования, тары и др. Общий расход воды на 1 м3 конечного продукта составляет около 15 м3. Поэтому к качеству воды предъявляются повышенные требования.
Вода должна быть безопасна в эпидемическом и радиационном отношении, безвредна по химическому составу, и обладать качествами питьевой воды, быть прозрачной, бесцветной, без запаха и привкуса.
В чистой природной воде всегда содержатся растворимые соли, которые оказывают влияние на вкус напитков, а также на ферментативные процессы. Содержание солей можно скорректировать соответствующей обработкой. В хорошей воде не должны присутствовать такие вещества, как NаНСО3, NH2, CO2, HNO3. Для питьевой воды существуют ограничения по микробиологическим, токсикологическим показателям и по компонентам, ухудшающим ее органолептические показатели.
Безвредность природной питьевой воды по вредным химическим веществам и веществам антропогенного происхождения контролируется соответствующими нормативными документами [3]:
Таблица 1.1
Требования к природной питьевой воде
|
Компонент |
ПДК, мг/дм3 |
|
1 |
2 |
|
Алюминий |
0,5 |
|
Барий |
0,1 |
|
Бериллий |
0,0002 |
|
Бор |
0,5 |
|
Кадмий |
0,001 |
|
Мышьяк |
0,05 |
|
Медь |
1 |
|
Молибден |
0,25 |
|
Никель |
0,1 |
|
Ртуть |
0,0005 |
|
Свинец |
0,03 |
|
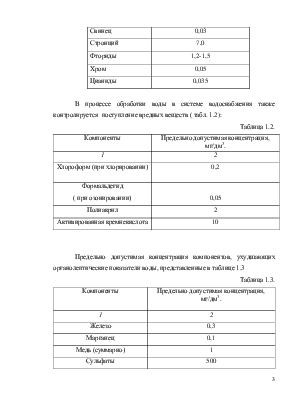
Стронций |
7,0 |
|
Фториды |
1,2-1,5 |
|
Хром |
0,05 |
|
Цианиды |
0,035 |
В процессе обработки воды в системе водоснабжения также контролируется поступление вредных веществ ( табл. 1.2):
Таблица 1.2.
|
Компоненты |
Предельно допустимая концентрация, мг/дм3. |
|
1 |
2 |
|
Хлороформ (при хлорировании) |
0,2 |
|
Формальдегид ( при озонировании) |
0,05 |
|
Полиакрил |
2 |
|
Активированная кремнекислота |
10 |
Предельно допустимая концентрация компонентов, ухудшающих органолептические показатели воды, представленные в таблице 1.3
Таблица 1.3.
|
Компоненты |
Предельно допустимая концентрация, мг/дм3. |
|
1 |
2 |
|
Железо |
0,3 |
|
Марганец |
0,1 |
|
Медь (суммарно) |
1 |
|
Сульфаты |
500 |
|
Хлориды |
350 |
|
Цинк |
5 |
|
Нитраты |
45 |
|
Полифосфаты |
3,5 |
|
Озон (остаточный) |
0,3 |
|
Хлор остаточный (свободный) |
0,3-0,5 |
|
Хлор остаточный (связанный) |
0,8-1,2 |
Присутствие солей железа в больших количествах нежелательно, так как они взаимодействуют с полифенольными веществами сырья и ухудшают цвет и вкус напитков.
Общая α – радиоактивность должна быть не более 0,1 Бк/дм3, общая β – радиоактивность не более 1,0 Бк/дм3.
Растворенные в воде соли кальция и магния характеризуют ее жесткость. Жесткость воды выражается в миллимолях Са и Mg, содержащихся в 1 дм3 воды. Один моль/дм3 жесткости соответствует 40,08 мг Са2+ или 24,32 мг Mg2+ в 1 дм3 воды. Ранее применялась единица измерения 1 мг-экв/дм3, что соответствовало 20,04 мг Са2+ или 12,16 мг Mg2+ в 1 дм3 воды.
По жесткости (в моль/дм3) воду классифицируют следующим образом, (таблица 1.4):
Таблица 1.4.
|
Жесткость |
Группа |
|
1 |
2 |
|
до 0,75 |
Очень мягкая |
|
0,75-1,5 |
Мягкая |
|
1,5-2,25 |
Средней жесткости |
|
2,25-3 |
Довольно жесткая |
|
3-5 |
Жесткая |
|
Свыше 5 |
Очень жесткая |
Различают жесткость временную, постоянную и общую.
Временная (карбонатная, устранимая) жесткость обусловлена присутствием растворимых в воде гидрокарбонатов [ Са(НСО3)2 и Мg(НСО3)2], которые
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.