Пусть при бесконечно малом изменении состояния тела количество теплоты dQ вызывает изменение температуры тела dT, тогда теплоёмкость тела в данном процессе выразится отношением:
![]()
или
![]()
Единицей теплоёмкости является Дж/К.
Теплоёмкость С зависит от внешних условий или
характера процесса, при котором происходит отвод или подвод теплоты. Так,
например, теплоёмкость газов в случае подвода теплоты при постоянном объеме ![]() отличается от удельной теплоёмкости газов
при постоянном давлении
отличается от удельной теплоёмкости газов
при постоянном давлении ![]() .
.
Удельная теплоёмкость есть отношение теплоёмкости к массе вещества.
![]() .
.
Если С выражается в Дж/К, m – в кг, то с – в Дж/(кг·К).
Объёмная теплоёмкость [Дж/(м![]() ·К)]
·К)]
![]() , где
, где ![]() и
и ![]() –
плотность и объём газа при нормальных физических условиях, кг/м
–
плотность и объём газа при нормальных физических условиях, кг/м![]() ; м
; м![]() .
.
Молярная теплоёмкость [Дж/(м![]() ·К)]
·К)]
![]() , где n – количество рабочего
вещества, моль.
, где n – количество рабочего
вещества, моль.
3. Формула Майера.
![]()
4. Формула для определения количества тепла при постоянной и переменной теплоёмкостях.
Пользуясь истинной удельной теплоёмкостью, требуёмое
количество теплоты для нагрева m вещества от
температуры ![]() до
до ![]() ºС
определим из выражения:
ºС
определим из выражения:
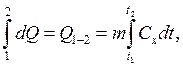
где 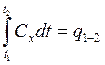 – требуемое количество
теплоты.
– требуемое количество
теплоты.
Здесь интеграл берётся по пути процесса от 1 до 2 (от
начального состояния до заданного конечного), так как изменение температуры
тела зависит от характера процесса, а с этим связанно изменение теплоёмкости
тела ![]() . Удельное количество теплоты
. Удельное количество теплоты ![]() является, таким образом, функцией процесса
и не является поэтому функцией состояния системы, изменения которой зависит
только от начального и конечного состояний.
является, таким образом, функцией процесса
и не является поэтому функцией состояния системы, изменения которой зависит
только от начального и конечного состояний.
Теплоёмкость газа не постоянна. Для идеального газа она является функцией температуры. Теплоёмкость зависит от температуры, а также от давления и объёма. При низких давлениях и высоких температурах теплоёмкость газа считают приближенно зависящей от температуры.
В общем случае истинная теплоёмкость для температуры t с достаточной степенью точности выражается для большинства газов уравнением второй степени (нелинейным)
![]() , где a, b,
e – постоянные,
определяемые для различных газов и видов теплоёмкости на основании
экспериментальных и теоретических данных.
, где a, b,
e – постоянные,
определяемые для различных газов и видов теплоёмкости на основании
экспериментальных и теоретических данных.
Количество теплоты в изохорном термодинамическом процессе:
![]()
и
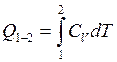
а при ![]()
![]()
где ![]() – удельная теплоёмкость тела при
постоянном объёме.
– удельная теплоёмкость тела при
постоянном объёме.
Количество теплоты изобарном термодинамическом процессе:
![]()
и
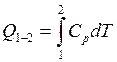
а при ![]()
![]()
где ![]() – удельная теплоёмкость тела при
постоянном давлении.
– удельная теплоёмкость тела при
постоянном давлении.
Количество теплоты в изотермическом термодинамическом процессе:
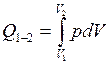 .
.
5. Физический смысл внутренней энергии и энтальпии газа. Формулы для их вычисления.
Внутреннюю энергию рассматривают с молекулярной точки зрения как сумму кинетической и потенциальной энергий, обусловленных хаотическим движением и взаимодействием молекул газа. Другие виды энергии не учитываются, так как при рассматриваемых в технической термодинамике температурах их влиянием на изменение состояния можно пренебречь.
Для реальных газов внутренняя энергия является функцией как
температуры ![]() , так и плотности газа
, так и плотности газа ![]() :
:
![]() .
.
Внутреннюю энергию можно найти из первого закона термодинамики:
![]() ,
,
Для изохорного процесса![]() .
.
Для изобарного ![]() .
.
Для изотермического ![]()
Для адиабатного ![]() .
.
Параметром состояния газа наряду с внутренней энергией является удельная энтропия:
![]()
она определяется исключительно функциями состояния (![]() ).
).
Энтальпия имеет особо важное значение для техники в случае непрерывного потока рабочего тела. С ее помощью значительно упрощаются рассмотрения процессов и их расчеты.
Величина i выражается в Дж/кг, если слагаемые u и pv – в Дж/кг.
Энтальпия представляет энергию, связанную с данным состоянием тела, т. е. является функцией состояния, поскольку u и pv – функции состояния.
В процессе с постоянным давлением ![]() :
:
![]()
т.е. изменение удельной энтальпии равно количеству теплоты,
подведенной к телу при ![]() .
.
Из выражения находим:
![]()
или
![]()
Энтальпия ![]()
![]() –
экстенсивная (аддитивная) величина. Удельная энтальпия
–
экстенсивная (аддитивная) величина. Удельная энтальпия ![]() обладает
интенсивными свойствами.
обладает
интенсивными свойствами.
Удельную теплоёмкость при постоянном давлении ![]() можно определить следующим образом:
можно определить следующим образом:
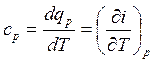
но
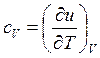
Сравнивая последние два выражения, видим, что при постоянном давлении удельная энтальпия обладает свойствами, аналогичные тем, которые имеет внутренняя энергия при постоянном объёме.
Из определения удельной энтальпии:
![]()
Поскольку внутренняя энергия ![]() является
лишь функцией температуры, то
является
лишь функцией температуры, то ![]() также зависит только от
температуры. Отсюда для идеального газа:
также зависит только от
температуры. Отсюда для идеального газа:
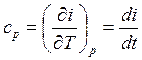
![]()
а при ![]() находим:
находим:
![]()
и для любого изменения от состояния 1 до состояния 2
![]()
6. Сущность калориметрического метода определения теплоёмкости газа.
Опытное определение изобарной теплоемкости газа ![]() сводиться к нагреву его в проточном
калориметре и измерению необходимых величин (количества тепла
сводиться к нагреву его в проточном
калориметре и измерению необходимых величин (количества тепла ![]() , объёмного расхода
, объёмного расхода ![]() и
повышения температуры
и
повышения температуры ![]() ). Полагая, что все тепло от
электронагревателя идёт в установившемся процессе на изобарный нагрев воздуха
(тепловые потери отсутствуют), теплоёмкость можно найти по формуле,
). Полагая, что все тепло от
электронагревателя идёт в установившемся процессе на изобарный нагрев воздуха
(тепловые потери отсутствуют), теплоёмкость можно найти по формуле, 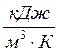 :
:
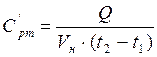
Я изучил первый закон термодинамики и все виды теплоёмкостей
газов. Освоил методику калориметрического эксперимента на примере определения
изобарной объёмной теплоёмкости воздуха, которая равна 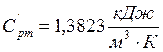 ,
величина расхождения между экспериментально определенной теплоёмкостью
,
величина расхождения между экспериментально определенной теплоёмкостью ![]() и табличным значением
и табличным значением ![]() равна
равна ![]()
![]() %, это обусловлено погрешностью измерений и
нагрева воздуха от электронасоса.
%, это обусловлено погрешностью измерений и
нагрева воздуха от электронасоса.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.