1. Методы фиксации атмосферного азота.
В 1902 году у Ниагарского водопада был реализован дуговой метод фиксации атмосферного азота. Процесс на промышленном производстве осуществлялся путем пропускания воздуха через пламя электрической дуги по реакции:
N2 + O2=2NO - 180,6 кДж
Условия равновесия этой эндотермической реакции при технически доступных температурах не позволяют получить значительных выходов окиси азота. Так, при 2400 °С концентрация NO может составить только 2,3%. При температуре выше 1000 °С окись азота быстро разлагается. Вследствие этого концентрация NO в газах, выходящих из дуговых печей, обычно не превышала 1,5—1,8%.
Других окислов азота в этих температурных условиях чески не образуется.
Равновесие этой реакции
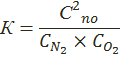
Если при 3000° К равновесная концентрация NO в воздухе по расчету составляет 3,78%, то при использовании исходного газа, содержащего 50% N2 и 50% О2, эта концентрация повышается до 4,67%.
Используя исходную смесь со стехиометрическим отношением N2 и О2 , можно достигнуть значительно большей скорости реакции, чем при применении воздуха. Однако вследствие незначительной степени превращения азота и кислорода в оксид азота использовать воздух, обогащенный кислородом, невыгодно.
Давление не влияет на смещение равновесия реакции в пределах температур, при которых не происходит диссоциации N2 и О2 на атомы. Однако в связи с тем, что синтез оксида азота при высоких температурах, диссоциация исходных компонентов на атомы оказывает существенное влияние на ход технологического процесса.
Константа скорости обратной реакции значительно превышает константу скорости прямой реакции. Поэтому необходимо охлаждать. Это представляет серьезные технические трудности. Вследствие высоких затрат энергии, сложности аппаратурного оформления и низкой концентрация NO в газе этот метод был вытеснен из промышленной практики другими процессами.
Цианамидный метод энергетически более выгоден. Он основан на способности тонкоизмельченного карбида кальция реагировать при температуре около 1000°С с молекулярным азотом с образованием кальцийцианамида по реакции:
СаС2 + N2 = СаСN + C + 301,45 кДж
В почве происходит гидролиз кальцийцианамида с образованием аммиака по реакции :
СаCN2 + ЗН2О = 2NH3 + СаСОз
С 1906 г. метод фиксации атмосферного азота через цианамид кальция стал быстро распространяться во многих странах, поскольку он оказался в 5-6 раз экономичнее дугового метода. Цианамид кальция содержит всего около 20% азота. Однако этот процесс энергетически более выгоден чем дуговой, но существенно уступает аммиачному методу фиксации атмосферного азота.
Аммиачный метод фиксации атмосферного азота энергетически наиболее выгоден. Он основан на синтезе аммиака из азото-водородной смеси, получаемой из углеродсодержащего сырья и воздуха, как источника азота.
Аммиак в дальнейшем перерабатывается в азотную кислоту, соли аммония, карбамид и другие соединения.
Первая промышленная установка синтеза аммиака из азото-водородной смеси была введена в эксплуатацию в 1913г. С тех пор этот метод стал доминирующим в химической промышленности.
В основе метода лежит реакция взаимодействия азота и водорода по реакции:
N2 + 3Н2 =2 NH3 - 111.6 кДж
Сравнительная энергоемкость этих методов фиксации азота приведена в таблице (2).
Таблица 2.
|
метод фиксации азота |
энергозатраты кДж/т |
|
дуговой |
7-10 4 |
|
цианамидный |
1.2 -104 |
|
аммиачный |
0.5 -104 |
Энергетически наиболее выгоден аммиачный метод фиксации, что и обусловило его широкое промышленное внедрение;
В последнее время дуговой метод, не получивший промышленного применения вследствие низкого выхода оксида азота и весьма высокого потребления электроэнергии, модифицируется в виде плазмохимического процесса, осуществляемого в низкотемпературной воздушной плазме. Процесс протекает при температуре 5*103 - 104 оС , давлении 2 МПа и времени контактирования 0.0001сек, что обеспечивает весьма высокую производительность плазменной установки. Комбинирование установки с магнитогидродинамическим генератором позволяет использовать вторичные энергоресурсы и обеспечить возврат энергии.Азотоводородная смесь для синтеза аммиака может быть получена газификацией газообразного и жидкого топлива, из коксового и водяного газов, электрохимическим методом путем разложения воды.
2. Для производства азото-водородной смеси для синтеза аммиака на азотнотуковых заводах широко применяются установки охлаждения технологических газов до низких температур. Их работа основана на различии свойств идеальных и реальных газов.
Дросселирование газа. Джоуль и Томсон определили величину изменение температуры реальных газов при их дросселировании. Процесс дросселирования происходит при постоянной энтальпии и является необратимым.
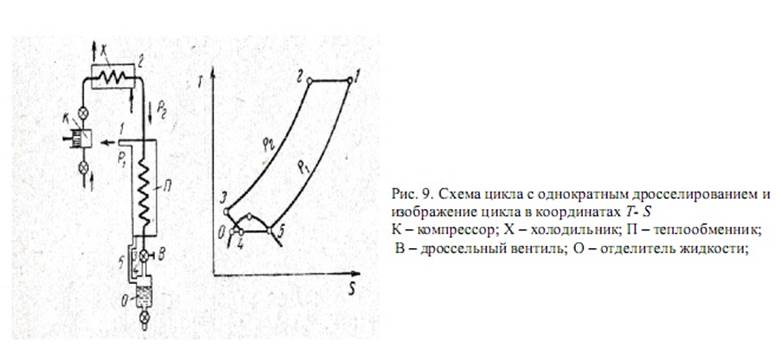
Цикл с однократным дросселированием
На рисунке 9 показана схема цикла с однократным дроселлированием и изображение этого цикла в координатах Т - S. Воздух сжимается в компрессоре высокого давления, охлаждается в холодильнике компрессора (линия 1 - 2), затем поступает в теплообменник, где охлаждается обратным потоком нескон- денсировавшегося воздуха (линия 2 - 3). Охлажденный воздух дросселируется ( линия 3 -4) и поступает в отделитель жидкости, где отделяется сжиженная часть воздуха. Несжиженный воздух в виде сухого насыщенного пара (точка 5) проходит межтрубное пространство теплообменника, отдавая свой холод встречному потоку воздуха (линия 5 — 1).
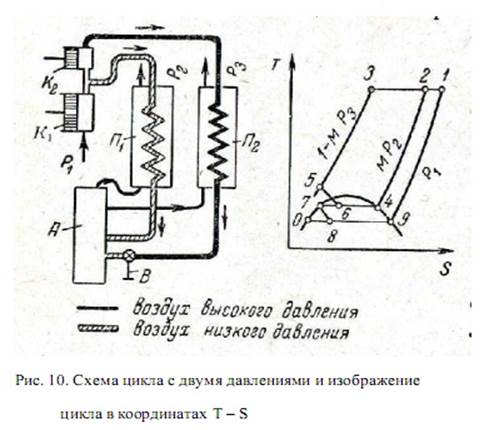
Цикл с двумя давлениями
На рис.10 показана схема цикла с двумя давлениями и изображение этого цикла в координатах T— S.Воздух сжимается в компрессоре низкого давления К1 от давления Р1 до Р2 . Часть воздуха в количестве М кг поступает в теплообменник низкого давления П1, где охлаждается потоком несжиженого воздуха, а затем направляется в ректификационную колонну А. Вторая часть воздуха в количестве (1 — М) кг поступает в компрессор высокого давления К2 , где сжимается от давления Р2 до Р3 . Затем воздух охлаждается в теплообменнике П2 и дросселируется в ректификационную колонну.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.