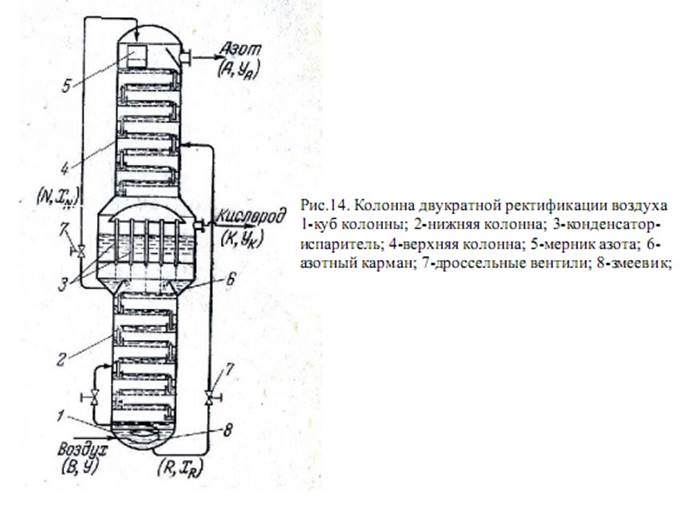
Давление в нижней колонне подбирают так, чтобы температура конденсации низкокипящего компонента (азота) в трубках конденсатора была выше температуры кипения высококипящего компонента (кислорода) в межтрубном пространстве. Температура конденсации азота под давлением 5,5—6,5 am составляет 95,5— 97,6 °К, температура кипения кислорода при 1,3—1,4 am находится в пределах 92,8—93,5°К- Следовательно, температурный напор в конденсаторе составляет 2—3 °К, что обеспечивает нормальный ход процесса.
Описанная колонна работает следующим образом. Воздух под давлением 120—200 am при температуре 145—155 °К поступает в змеевик 8, находящийся в кубе нижней колонны. В этих условиях воздушно - кислородная смесь кипит в пределах 98—101 °К, при этом поступающий воздух охлаждается до 110°К и частично конденсируется. Далее воздух дросселируется до давления 6 am и подается на нижние тарелки колонны 2. Пары его, содержащие до 90% N2, поднимаются вверх, жидкость, в которой находится 60—65% N2, стекает в куб. На верхних тарелках нижней колонны содержание азота в парах достигает 98—99,5%, далее пары конденсируются в трубках аппарата 3. Часть жидкого азота (флегма) стекает на тарелки нижней колонны, остальной азот собирается в карманах 6. Отсюда жидкость через дроссельный вентиль поступает на орошение верхней колонны. Азотная флегма в обеих колоннах поглощает «проскакивающие» вверх пары кислорода, что предотвращает значительные потери О2 с азотом, отбираемым сверху. Воздушно-кислородная смесь из куба нижней колонны дроссе
лируется в среднюю часть верхней колонны. Стекая вниз, смесь обогащается кислородом, пары которого поднимаются снизу.
Азот испаряется из воздушно-кислородной смеси и пары его поднимаются вверх. Кислород отбирают из верхней части конденсатора-испарителя.
Тепло, необходимое для ведения процесса ректификации, подводится в колонну с воздухом, поступающим на разделение. В верхнюю колонну тепло передается парами азота, нагревающими кислород в конденсаторе.
2. Переработку оксидов азота, полученных окислением N0, в разбавленную азотную кислоту в промышленности проводят путем их абсорбции из газовой фазы водой или водным раствором азотной кислоты. Для этого нитрозные газы охлаждают и направляют в поглотительные башни или абсорбционные колонны, где происходят окисление N0 и поглощение образовавшихся оксидов азота. В зависимости от условий охлаждения и окисления в газовой фазе могут присутствовать оксиды азота различной степени окисления. Все они, за исключением NO, реагируют с водой c образованием азотной и азотистой кислоты.
Из двуокиси и четырехокиси азота образуются эквивалентные количества азотной и азотистой кислот. Практически безразлично, что реагирует с водой — двуокись или четырехокись азота, так как скорость их взаимного превращения очень велика, а количество образующихся из NO2 и N2O4 азотистой и азотной кислот одинаково.
Азотистая кислота, образующаяся при абсорбции оксидов азота водой, малоустойчива и разлагается на азотную кислоту и NO. Выделившаяся в газовую фазу NO вновь окисляется содержащимся в нитрозном газе кислородом до NO2 и вновь взаимодействует с поглотительным раствором с образованием азотной и азотистой кслот.
Суммарная реакция образования азотной кислоты описывается уравнениями: 2NO2 + Н20 = HNO2 + HNO3
3HNO2 = HNO3 + 2NO + Н20
3NO2 + H2O= 2HNO3 + NO +136,2 кДж
При меньших степенях окисления NO:
N2O3 + Н20 = 2HNO2
3HNO2 = HNO3 + 2NO + H2O
3N2O3 + H2O = 2HNO3 + 4NO
При степени окисления газа менее 50% растворы азотной кислоты поглощают оксиды азота в виде NO + NO2. При высокой степени окисления газа происходит поглощение оксидов азота виде NO2. 0бычно все расчеты проводят исходя из этого механизма.
Константу равновесия реакции обычно разбивают на два сомножителя:
Ki =PNO /p3NO2 K2 =p2HNO3 /PH20
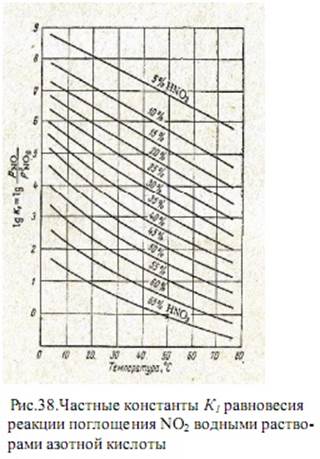
При этом, если константа равновесия КР зависит, как обычно, только от температуры, то K1 и K2 зависят и от содержания кислоты в растворе. На практике расчет процесса абсорбции обычно ведут пользуясь значениямиK1.
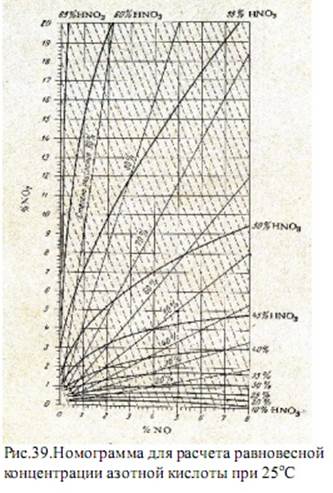
На рисунке 38 приведены значения К1 для различных концентраций азотной кислоты. На рисунке 39 изображена номограмма, представляющая зависимость равновесной концентрации азотной кислоты от содержания NO и NO2 в нитрозном газе при 25оС. Из номограммы следует, что из нитрозного газа, образующегося при контактном окислении аммиака в аммиачно-воздушной смеси, получение азотной кислоты концентрации выше 60% практически невозможно. Этим и объясняются стандарты на неконцентрированную азотную кислоту.
Главными факторами, определяющими большуя скорость образования азотной кислоты из оксида азота является проведение процесса абсорбции под давлением при пониженных температурах с применением богатых по содержанию оксидов азота нитрозных газов и создание условий для более полного соприкосновения газа с жидкостью.
В промышленности нашли применение установки для получения азотной кислоты, в которых абсорбция оксидов азота проводится при разных давлениях от 1 до 11 атмосфер. Применение повышенного давления позволяет достичь высокой степени поглощения нитрозных газов и добиться санитарной нормы их содержания в выхлопном газе. Уменьшение размеров абсорбционных колонн позволяет снизить аммортизационные отчисления и удельные капитальные затраты.
Повышение мощности агрегатов в сочетании с применением более высокого давления при абсорбции оксидов азота дает возможность снизить себестоимость продукции. Путем использования теплоты реакции окисления аммиака можно обеспечитьь ведение процесса при минимальных энергетических затратах на сжатие воздуха или нитрозных газов, рекуперируя затраченную на сжатие газов энергию.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.