Санкт-Петербургский государственный
архитектурно-строительный университет
_____________________________________________________________________________
Курсовая работа по дисциплине
«Региональные вопросы водоснабжения»»
Выполнил студент гр.2-В-4:
Никитин А.В.
Принял преподаватель:
Езерский А.И.
Санкт-Петербург
2014
Анализ исходных данных
Качество воды должно удовлетворять качеству СанПиН 2.1.4-1074 цветность не более 20 град., мутность 1,5 мг/л, запахи и привкусы не более 2 баллов.
Исходные данные не соответствуют требованиям СанПиН «вода питьевая», поэтому вода должна быть обработана до требуемого качества.
I. Определение содержания в источнике бикарбонатных анионов угольной кислоты
Летом: ![]()
Зимой: ![]()
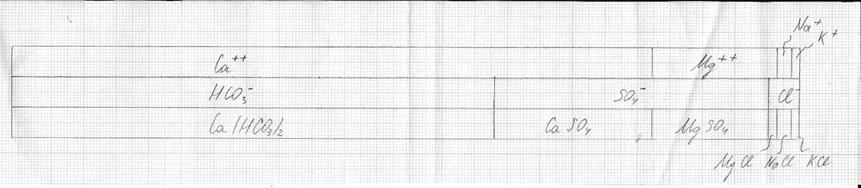
II. Определение ионного состава воды источника
![]()
![]()
![]()
![]()
![]()
![]()
![]()
Р- общее солесодержание
Р=25,1+4,7+1,0+1,0+79,3+15,3+3,4= 129,2 г/м3
Поскольку вода как электролит электрически нейтральна, то проверяем равенство суммы катионов и анионов в исходной воде, выраженных в эквивалентных единицах.
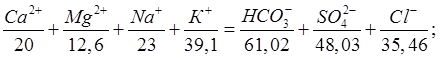
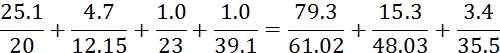
1.255+0.387+0.043+0.0256=1.299+0.318+0.096
1.71=1.71 – вода электрически нейтральна.
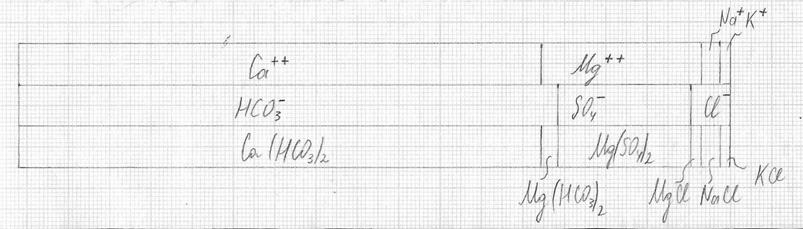
III. Оценка уровня стабильности воды
а) зимний период
t ͦ = 0 ͦ С;
рН=7.3;
Щ=2.0 г-экв/м3
1.
Содержание аниона ![]() зимой увеличивается по сравнению с усредненными
показателями на следующую величину:
зимой увеличивается по сравнению с усредненными
показателями на следующую величину:
2.0∙61.02 – 79.3=42.74 г/м3
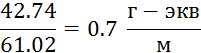
2. Зимой содержание ![]() увеличивается на 0,7 г-экв/м3.
увеличивается на 0,7 г-экв/м3.
0,7∙40,1/2=14,03 г /м3.
3. Тогда содержание ![]() зимой составит:
зимой составит:
14,03+25,1=39,13 г /м3.
4. Стабильность воды определяется показателем индекса стабильности (индекс Ланжелье).
J=рН0-рНs,
где рН0 - рН исходной воды,
рНs- рН при насыщении воды карбонатом кальция.
5. Солесодержание зимой увеличивается и составит:
Р= 129,8+14,03+42,74=186,57 г/м3
6.
По номограмме СНиПа, приложение №5 определяем рНs при
следующих показателях: Р, ![]() , Щ, t ͦ
, Щ, t ͦ
рНs=8,1
J=7,3-8,1=-0,8 - вода коррозионная.
б) летний период
t ͦ = 17 ͦ С;
рН=7,1;
Щ=1,0 г-экв/м3
1. Содержание![]() снижается:
снижается:
79,3 -1,0 . 61,02 = 18,28 г/м3
2. Щелочность также снижается на следующую величину:
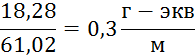
3. Содержание ионов ![]() также снижается на величину:
также снижается на величину:
0,3∙20=6 г – экв / м3
4. Тогда содержание ![]() составит:
составит:
25,1-6= 19,1 г / м3
5. Определяем солесодержание воды летом:
Р = 129,8– 18,3 – 6 = 105,5 г / м3
6. По номограмме определяем pHs:
рНs = 8,4
J = 7,1 – 8,4 = -1,3
Значит летом вода более агрессивна.
IV. Определение расчетных доз реагентов для коагулирования воды
а) Доза коагулянта по мутности определяется по СНиП, табл. 16
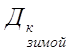 = 30 г / м3
= 30 г / м3
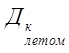 = 39 г / м3
= 39 г / м3
б) Доза коагулянта по цветности:
![]() г / м3
г / м3
![]() г / м3
г / м3
Следовательно, доза коагулянта принимается по мутности.
V. Расчет изменения ионного состава воды после ее реагентной обработки
а) зимой
1.Общая жесткость воды до коагулирования:
![]() г – экв / м3
г – экв / м3
2.Щелочность воды до коагулирования:
Що = 2,0 г – экв / м3
3. Некарбонатная жесткость воды до коагулирования
Жнк = Жо – Що = 2,34 -2,0 = 0,34 г – экв / м3
4. Доза коагулянта зимой:
![]() г / м3
г / м3
5. Щелочность воды после коагулирования зимой:
![]() г – экв / м3
г – экв / м3
6. Доза подщелачивающего реагента зимой:
![]() г – экв / м3
г – экв / м3
Т.к. значение дозы
подщелачивающего реагента ![]() отрицательное, то
подщелачивание не требуется.
отрицательное, то
подщелачивание не требуется.
7. Общее солесодержание воды после коагулирования:
![]()
![]() г / м3
г / м3
8. Содержание свободной углекислоты в исходной воде определяем по номограмме СНиП (приложение №5) в зависимости от Р=186,57 г / м3, t ͦ = 0 ͦ С; рН=7,3; Щ=2,0 г-экв/м3
[CO2]исх=16 г / м3
11. Количество свободной углекислоты после коагулирования зимой увеличится и составит:
[CO2]=![]() г-экв/м3
г-экв/м3
12. По номограмме определяем рН воды после коагулирования и подщелачиванияпри следующих исходных данных: t ͦ = 0 ͦ С; Щ=1,47 г-экв/м3,
Р=179,7 г / м3,СО2=44∙0,9=39,6 г / м3
рН=6,8
13. Содержание ![]() после
обработки воды составит:
после
обработки воды составит:
![]() г-экв/м3
г-экв/м3
14. Содержание анионов SO4 увеличилось и составит:
![]() г-экв/м3
г-экв/м3
15. Проверяется равенство в исходной воде катионов и анионов:
1,95+0,386+0,043+0,025=1,47+0,84+0,096
2,4=2,4
13. Строим диаграмму гипотетического состава воды после коагулирования и подщелачивания.
б) В летний период
1. Общая жесткость воды до коагулирования:
![]() г -экв/м3,
г -экв/м3,
2.Щелочность воды до коагулирования:
Що = 1,0 г – экв / м3
3. Некарбонатная жесткость воды до коагулирования
Жнк = Жо – Що = 1,34-1,0 = 0,34 г – экв / м3
4. Доза коагулянта летом:
![]() г / м3
г / м3
5. Щелочность воды после коагулирования летом:
![]() г – экв / м3
г – экв / м3
6. Доза подщелачивающего реагента летом:
![]() г – экв / м3
г – экв / м3
Летом требуется подщелачивание.
7. Доза извести для подщелачивания:
![]() г / м3
г / м3
8. Общее солесодержание воды после коагулирования летом:
![]() г / м3
г / м3
9. Щелочность воды после коагулирования и подщелачивания
![]() г – экв / м3
г – экв / м3
10. Содержание анионов SO4 после коагулирования воды:
![]() г-экв/м3
г-экв/м3
11. Содержание в воде ионов Ca++ после подщелачивания:
![]() г-экв/м3
г-экв/м3
12. Содержание свободной углекислоты в исходной воде определяем по номограмме СНиПа - приложение №5 в зависимости от Р=105,5 г / м3,
t ͦ =17 ͦ С; рН=7,1; Щ=1,0 г-экв/м3
[CO2]исх=8,5 г / м3
13. Содержание свободной углекислоты после коагулирования и подщелачивания составит:
[CO2]=![]() г-экв/м3
г-экв/м3
14. По номограмме определяем рН воды после реагентной обработки воды при следующих исходных данных : t ͦ = 17 ͦ С; Щ=1,0 г-экв/м3, Р=110,2 г / м3, СО2=44∙0.19= 8,36 г / м3
рН=7,2
10. Строим диаграмму гипотетического состава воды после коагулирования и подщелачивания.
1,64+0,386+0,043+0,025=1,0+1,0+0,096
2,09=2,09

VI. Оценка уровня стабильности воды после реагентной обработки
а) в зимний период
Щ=1,47 г-экв/м3
t ͦ = 0 ͦ С;
рН=6,8;
P=179,7 г / м3;
Са=39 г / м3
По номограмме определяем рНs = 8,2
Индекс стабильности:
J=рН0-рНs
J=6,8-8,2=-1,4 – вода агрессивная.
б) в летний период
Щ=1,0 г-экв/м3
t ͦ = 17 ͦ С;
рН=7,2;
P=110,2 г / м3;
Са=38,2 г / м3
По номограмме определяем рНs = 8,1
Индекс стабильности:
J=рН0-рНs
J=7,2-8.1=-0,9– вода агрессивная
Список использованной литературы
1. СНиП 2.04.02-84 “Водоснабжение. Наружные сети и сооружения”. М.:1996г.
2. СанПиН 2.1.4.1074-01 “Питьевая вода и водоснабжение населенных мест. Гигиенические требования к качеству воды централизованных систем питьевого водоснабжения. Контроль качества”.
3. Справочник по свойствам, методам анализа и очистки воды. Под ред. Л. А. Кульский, И. Т. Гороновский и др. ч.1.,Киев 1980г.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.