


19 вопрос (Гидрометаллургическая переработка медных руд)
гидрометаллургическая переработка медных руд
Бедные окисленные и смешанные медные руды, трудно поддающиеся обогащению, перерабатывают гидрометаллургическими способами. Медь из таких руд выщелачивают растворами серной кислоты или солей аммония (рис.26).
Выщелачивание проводят подземным способом (в кучах), просачиванием или перемешиванием пульп
Серная кислота легко переводит в раствор окисленные минералы, например малахит, по реакции:
СuСОз • Сu(ОН)2 + 2H2SO4 → 2CuSO4 + СО2 + ЗН2О.
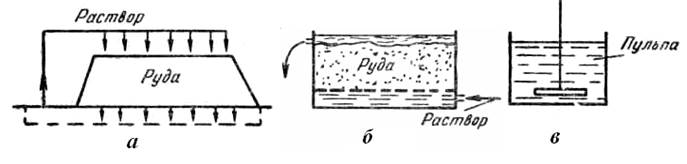
Рис. 26. Способы выщелачивания меди из руд: а – выщелачивание в кучах; б – выщелачивание просачиванием (перколяция); в – выщелачивание в пульпе
Сульфидные минералы не реагируют с серной кислотой, только ковеллин и халькозин медленно взаимодействуют с ней и частично переходят в раствор.
Попутно с медью серная кислота растворяет минералы железа, поэтому в растворах постепенно накапливается сульфат оксида железа Fe2(SO4)3, способный реагировать с сульфидами меди, например,
CuS + Fe2(SO4)3 → CuSO4 + 2FeSO4 + S.
Халькопирит и борнит взаимодействуют с ионами трехвалентного железа медленно и неполно.
Из полученных растворов медь осаждают цементацией железным скрапом по реакции:
CuSO4 + Fe → FeSO4 + Сu↓.
После отделения осадка растворы возвращают на выщелачивание. Fe (II), в них окисляется кислородом воздуха до Fe (III), которое вновь растворяет минералы меди. Осадок цементной меди переплавляют и рафинируют.
1. Подземное выщелачивание может происходить естественным путем в результате накопления воды в горных выработках. Серная кислота образуется здесь от гидролиза солей железа:
Fe2(SO4)3 + 2Н2О = 2Fe(ОН)SO4 + H2SO4.
Рудничные воды откачивают и осаждают из них медь цементацией.
Возвращая отработанные растворы в толщу рудного тела через сделанные для этого скважины, шурфы и канавы, достигают более полного и интенсивного выщелачивания меди.
2. Выщелачивание в кучах, известное с древних времен, иногда практикуется и в наши дни. Для этого бедную руду складывают на несколько наклонной водонепроницаемой площадке в большие кучи, имеющие форму усеченных пирамид. Растворы подают на кучу сверху и отводят их по канавам к цементационным установкам. Выщелачивание длится несколько лет, но кучи велики: в каждой из них десятки тысяч тонн руды, поэтому производительность может быть достаточно высокой.
3. Выщелачивание просачиванием подобно кучному, только руду загружают в прямоугольные бетонные или круглые деревянные чаны на ложное дырчатое дно из досок. Мелкие частицы предварительно удаляют классификацией, поэтому растворы просачиваются быстрее и выщелачивание проходит интенсивнее, чем в кучах.
4. Выщелачивание перемешиванием пульпы применяется для мелких фракций руды, трудно проницаемых для растворов при просачивании. Этот способ сравнительно дорог из-за больших затрат энергии на измельчение и перемешивание, однако он обеспечивает наиболее высокое извлечение меди в растворы.
Независимо от способа выщелачивания медь чаще всего осаждают из растворов цементацией; однако в некоторых случаях при получении богатых растворов выгодно электролитическое ее осаждение. Плотные электролитные осадки содержат не менее 99 % Сu, в то время как в рыхлых цементных осадках обычно не более 50–80 % Сu. Осаждение меди электролизом проводят в ваннах с нерастворимым свинцовым анодом. При этом на катоде разряжаются ионы Сu2+, на аноде молекулы воды разлагаются с выделением кислорода, а в растворе регенерируется серная кислота, нужная для выщелачивания. Процесс электролиза меди можно представить следующей схемой:
2CuSO4![]() 2Cu2+ + 2SO
2Cu2+ + 2SO![]() .
.
Ha катоде:
2Cu2+ + 4е–→ 2Cu; E° = + 0,34 в.
На аноде:
2Н2О – 4е– = О2 + 4Н+; E° = + 1,23 в.
Суммарно:
2CuSO4 + 2Н2О
→ 2Cu + 2SO![]() + 4H+.
+ 4H+.
Потенциал процесса разложения молекул воды, включая перенапряжение кислорода, отрицательнее, чем потенциал реакции:
2SO![]() – 2е = S2O
– 2е = S2O![]() Е° = 2,01 в.
Е° = 2,01 в.
На аноде всегда в первую очередь разряжаются анионы с более отрицательными потенциалами.
Растворы, загрязненные сульфатом окиси железа, невыгодны для электролиза: ионы Fe3+ восстанавливаются на катоде вместе с медью, вызывая непроизводительный расход электроэнергии. Потенциал реакции восстановления железа на катоде положительнее потенциала меди:
Fe3+ + 2е = Fe2+, E° = 0,77 в.
В этих случаях железо предварительно удаляют из раствора либо восстанавливают его сернистым газом или цементной медью.
5. Выщелачивание солями аммония применяют для переработки окисленных и самородных руд.
Окисленные минералы меди легко образуют растворимые комплексные соединения с аммиаком. Для этого руду выщелачивают, просачивая через ее слой раствор углекислого аммония, содержащий аммиак.
Окисленная медь растворяется по реакции:
CuO + 2NH![]() + 2NH4OH → Сu (NH3)
+ 2NH4OH → Сu (NH3)![]() + 3H2О.
+ 3H2О.
Комплекс двухвалентной меди способен растворять металлическую – самородную медь:
Сu (NH3)![]() + Сu → 2Сu (NH3)
+ Сu → 2Сu (NH3)![]() .
.
Действием кислорода воздуха в присутствии аммонийных солей комплекс одновалентной меди окисляется и вновь становится растворителем для меди:
2Cu(NH3)![]() + 2NH
+ 2NH![]() +
+![]() O2+2NH4OH
→ 2Cu(NH3)
O2+2NH4OH
→ 2Cu(NH3)![]() +3H2O.
+3H2O.
После накопления меди в растворе в результате просачивания его через руду и продувки воздухом аммиачные комплексы разлагают острым паром:
Сu (NH3)4СО3 → CuO + 4NH3 + СО2.
Выпадающий при этом осадок CuO плавят с углем, получая медь, а газообразные аммиак и углекислоту возвращают на выщелачивание.
Гидрометаллургические способы имеют ограниченное применение – ими получают не более 10–12% всей меди. Главный недостаток гидрометаллургии – невозможность попутного извлечения золота и серебра, присутствующих почти во всех медных рудах. Гидрометаллургические способы выгодны, когда пустая порода не реагирует с реагентами–растворителями.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.