28 вопрос (Электролитическое рафинирование меди. Регенерация электролита. переработка шлама)
6.11. Электролитическое рафинирование
Медные аноды помещают в ванну с раствором сернокислой меди и серной кислоты. Параллельно анодам подвешивают тонкие листы из чистой меди — катодные основы. Аноды соединяют с положительным, а катодные основы — с отрицательным полюсом источника постоянного электрического тока.
Анодная медь растворяется по реакции:
Cu + 2e → Cu2+.
В результате этого потенциал анода приобретает величину, близкую к (+0,34 в), при которой возможны следующие электрохимические реакции растворения примесей:
Zn – 2е ![]() Zn2+;
E° = – 0,76 в;
Zn2+;
E° = – 0,76 в;
Fe – ![]() Fe2+; E° = – 0,44 в;
Fe2+; E° = – 0,44 в;
Pb + SO![]() + 2е
+ 2е ![]() PbSO4;
E°= – 0,36 в;
PbSO4;
E°= – 0,36 в;
Ni – 2е ![]() Ni2+; E° = – 0,24 в;
Ni2+; E° = – 0,24 в;
Sn + 2e ![]() Sn2+; E° = – 0,14 в;
Sn2+; E° = – 0,14 в;
2Sb + ЗН2О – 6е ![]() Sb2O3 + 6H+ E° =
Sb2O3 + 6H+ E° =![]() 0,15 в;
0,15 в;
As + 2Н2О – 3е ![]() HAsO2 +
3Н+; E° = + 0,25 в.
HAsO2 +
3Н+; E° = + 0,25 в.
Золото и серебро не растворяются на аноде, так как
Ag – е ![]() Ag+; E° = 0,80 в;
Ag+; E° = 0,80 в;
Au – 3е ![]() Аu3+; E°
Аu3+; E° ![]() 1,50 в.
1,50 в.
Нерастворившиеся частицы благородных металлов выпадают в осадок, образуя на дне ванны шлам, в который переходят также примеси серы, селена, теллура, присутствующие в меди в виде Cu2S, Cu2Se, Cu2Te и других нерастворимых соединений. Сурьма и мышьяк в результате гидролиза и окисления кислородом воздуха образуют труднорастворимые соединения, часть которых выпадает в шлам, а часть остается в электролите в виде взвеси – плавучий шлам.
Из электролита ионы меди восстанавливаются на катоде по реакции:
Cu2+ + 2e → Cu; Е° = + 0,34 в.
Возникающие при этом нейтральные атомы образуют кристаллы меди, прочно пристающие к катодной основе. Из данных о потенциалах образования ионов примесей следует, что они не могут осаждаться на катоде вместе с медью. Примеси цинка, железа, висмута, мышьяка, никеля, сурьмы и олова более электроотрицательны, они остаются и накапливаются в электролите.
Загрязнение катодного осадка примесями происходит главным образом в результате захвата электролита и плавучего шлама. Для предупреждения этого часть электролита периодически удаляют из ванн и очищают (регенерируют), а затем снова возвращают в ванны. Иногда выведенный электролит перерабатывают отдельно, а в ванны заливают разбавленную серную кислоту.
Затраты на электроэнергию составляют значительную долю себестоимости электролитического рафинирования. Они выражаются произведением количества тока и напряжения на ванне, отнесенным к одной тонне меди:
W = I t V кВт • ч/т.
Количество тока, необходимое для
получения одной тонны катодной меди, легко вычислить по закону Фарадея. Если на
выделение из раствора одного грамм-эквивалента меди, т. е. 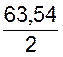 = 31,77 г, требуется 26,8 а•ч, то на тонну будет израсходовано:
= 31,77 г, требуется 26,8 а•ч, то на тонну будет израсходовано:
(I t)т =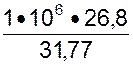 =
0,84•106 а•ч,
=
0,84•106 а•ч,
где I – сила тока, а;
t – время, ч;
(I t)T – теоретическое количество тока, а•ч. В действительности, не весь ток используется на выделение меди, часть его теряется в результате коротких замыканий между электродами, побочных цепей и разряда ионов примесей. Коэффициент полезного использования тока – выход по току равен отношению теоретически необходимого количества тока к фактическим его затратам:
Kт = 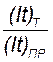 .
.
Таким образом, фактические затраты тока на тонну катодной меди составят:
(I t)ПР = 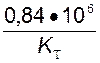 а•ч/т.
а•ч/т.
Для определения расхода энергии количество тока следует умножить на напряжение ванны:
W= (I t)ПР
V = 0,84•103
![]() кВт•ч/т.
кВт•ч/т.
Полученный результат убеждает нас в том, что основные условия экономичного проведения электролиза – высокий выход по току и малое падение напряжения на ванне.
Напряжение на ванне – это главным образом работа переноса ионов Сu2+ через электролит от анода до катода. Она равна произведению силы тока в амперах на сопротивление слоя электролита в Омах:
V = IR.
Величина R включает в себя также сопротивление самих электродов и мест контакта их с внешней цепью.
Удельное сопротивление растворов сернокислой меди несколько возрастает с увеличением концентрации CuSO4, но резко снижается при подкислении их серной кислотой и повышении температуры.
Стремясь к снижению напряжения на ванне, электролиз ведут
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.