Министерство образования и науки Российской Федерации
Федеральное агентство по образованию
ГОУ ВПО «Магнитогорский государственный технический университет им. Г.И. Носова»
материалов и физической химии
Расчетно-графическое задание №1
«Термодинамический анализ химических реакций»
Методические указания к расчету химического равновесия по курсу “Физическая химия” для студентов всех специальностей дневного и заочного образования
Магнитогорск
- 2008 Составитель: А.Н. Смирнов
С.П. Клочковский
Н.Ю.Свечникова
С.В.Юдина
Расчетно-графическое задание №1 «Термодинамический анализ химических реакций». Методические указания к расчету химического равновесия по курсу “Физическая химия” для студентов всех специальностей дневного и заочного образования
Магнитогорск: МГТУ, 2008 г.
Рецензент: Сибагатуллин С.К.
@А.Н.Смирнов, С.П.Клочковский, Н.Ю.Свечникова, С.В.Юдина, 2008 г.
ОГЛАВЛЕНИЕ
1. Формулировка задания ……………………………………………………..3
2. Исходные данные для выполнения задания …………………………….4
3. Пример решения задания…………………………………………………..18
3.1.Исследование 1 …………………………………………….……..…….18
3.1.1. Расчет изменения изобарной теплоемкости и теплового эффекта ….…………………………………………………….……...18
3.1.2. Расчет изменения энтропии….………………………….……..22
3.1.3. Расчет изменения энергии Гиббса….……….……..……..……23
3.1.4. Вывод уравнения зависимости константы равновесия от температуры ………………..………………………….….….…....24
3.2. Исследование 2. …………………………………………………..…..27
3.2.1.Определение количеств фаз, независимых компонентов и степеней свободы………………………………………………….….27
3.2.2. Определение возможного направления реакции……………...28
3.2.3. Определение равновесного состава газовой смеси…………...29
3.2.5. Другие случаи расчета равновесного состава газовой смеси..30
3.2.5. Установление направления смещения равновесия…………...33
Список библиографических источников…..…………………………………..34
Приложение 1. Требования к выполнению задания..…………………...……35
Приложение 2. Образец оформления титульного листа……………………...36
Приложение 3. Справочный материал 37
1. ФОРМУЛИРОВКА ЗАДАНИЯ
Исследование 1
Для реакции aA + bB = cC + dD + eE(вариант и номер задания указаны в колонках 1 и 2 табл.1), где A, B, C, D – вещества – участники реакции (колонки 3-7 в табл.1); a, b, c, d, e – стехиометрические коэффициенты реакции выполнить следующее:
1.1.Составить уравнение зависимости от температуры величины теплового эффекта DН°т = f(T) и изменения энтропии DS°т = f(T).
1.2.Вычислить величины DCp, DH°т , DS°т, DG°т и lnКр при нескольких температурах, значения которых задаются температурным интервалом и шагом температур (колонки 8 и 9 в табл.1). Полученные значения используются при построении графиков в координатах DCp – Т; DH°т – T; DS°т – T; DG°т – T и lnКр – 1/T.
1.3.Пользуясь графиком lnКр – 1/T , вывести приближенное уравнение вида lnКр = А/T + B, где А, В – постоянные.
Исследование 2
2.1. Используя правило фаз Гиббса, для рассматриваемой системы определить количества фаз, независимых компонентов и число степеней свободы.
2.2. Определить возможное направление протекания исследуемой реакции и равновесный состав газовой фазы при давлении (кПа) и температуре (К), указанных в колонках 16 и 17, соответственно, табл.1. При решении задачи использовать выведенное в исследовании 1 эмпирическое уравнение lnКр=А/T+B и данные об исходном составе газовой фазы (колонки 11 – 15 в табл.1).
2.3. Установить направление смещения состояния равновесия расматриваемой системы при:
а) увеличении давления (постоянная температура);
б) увеличении температуры (постоянное давление).
2. ИСХОДНЫЕ ДАННЫЕ
Исходные данные для выполнения
|
№ варианта |
№ задания |
Исследование 1 |
||||||
|
Схема реакции: aA + bB = cC + dD + eE |
Температурный интервал, К |
Шаг по темпе-ратуре |
||||||
|
Компоненты |
||||||||
|
A |
B |
C |
D |
E |
||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
|
1 |
1 |
AgJ(тв) |
Н2(газ) |
Ag(тв) |
HJ(газ) |
- |
300 - 420 |
20 |
|
2 |
AlCl3(тв) |
Н2(газ) |
Al(тв) |
HCl(газ) |
- |
300 - 440 |
20 |
|
|
3 |
AgBr(тв) |
Н2(газ) |
Ag(тв) |
HBr(газ) |
- |
450 - 700 |
50 |
|
|
4 |
AlBr3(тв) |
Н2(газ) |
Al(тв) |
HBr(газ) |
- |
300 - 370 |
10 |
|
|
5 |
Nb2O5(тв) |
Н2(газ) |
NbO(тв) |
H2O(газ) |
- |
1750-2000 |
50 |
|
|
6 |
Aс2O3(тв) |
Cl2(газ) |
AсCl3(тв) |
O2(газ) |
- |
1050 -1350 |
50 |
|
|
7 |
B2O3(тв) |
Cl2(газ) |
BCl3(газ) |
O2(газ) |
- |
600 - 700 |
20 |
|
|
8 |
Ba2O(тв) |
Cl2(газ) |
BaCl2(тв) |
O2(газ) |
- |
550 - 800 |
50 |
|
|
9 |
BiO(тв) |
Cl2(газ) |
BiCl(тв) |
O2(газ) |
- |
350 - 600 |
50 |
|
|
10 |
Cr2O3(тв) |
Cl2(газ) |
CrCl3(тв) |
O2(газ) |
- |
300 - 700 |
100 |
|
|
11 |
CdO(тв) |
CO(газ) |
Cd(тв) |
СO2(газ) |
- |
350 - 550 |
20 |
|
|
12 |
Al2O3(тв) |
CO(газ) |
Al(тв) |
CO2(газ) |
- |
450 - 700 |
50 |
|
|
13 |
TiC(тв) |
O2(газ) |
TiO2(тв) |
CO(газ) |
- |
1600 - 2100 |
100 |
|
|
14 |
TiC(тв) |
O2(газ) |
Ti(тв) |
CO(газ) |
- |
600 - 1100 |
100 |
|
|
15 |
CaC2(тв) |
O2(газ) |
CaO(тв) |
CO(газ) |
- |
400 - 700 |
50 |
|
|
16 |
PbS(тв) |
O2(газ) |
Pb(тв) |
SO3(газ) |
- |
460 - 600 |
20 |
|
|
17 |
B2O3(тв) |
CO(газ) |
B(тв) |
CO2(газ) |
- |
460 - 600 |
20 |
|
|
18 |
V2O3(тв) |
CO(газ) |
V(тв) |
CO2(газ) |
- |
1860 - 2000 |
20 |
|
|
19 |
TiO2(тв) |
CO(газ) |
Ti(тв) |
CO2(газ) |
- |
980 - 1120 |
20 |
|
|
20 |
V2O5(тв) |
CO(газ) |
V2O3(тв) |
CO2(газ) |
- |
700 - 1000 |
50 |
|
|
21 |
NbO2(тв) |
Н2(газ) |
NbO(тв) |
Н2O(газ) |
- |
750 - 1050 |
50 |
|
|
22 |
TiO2(тв) |
Н2(газ) |
Ti(тв) |
Н2O(газ) |
- |
1000 - 1140 |
20 |
|
|
23 |
CdBr2(тв) |
HCl(газ) |
CdCl2(тв) |
HBr(газ) |
- |
770 - 830 |
10 |
|
|
24 |
MgSiO3(тв) |
Н2(газ) |
MgO(тв) |
Si(тв) |
Н2O(газ) |
1520 - 1680 |
20 |
|
|
25 |
FeS(тв) |
HCl(газ) |
FeCl2(тв) |
H2S(газ) |
- |
300 - 400 |
20 |
|
Таблица 1
расчетно-графического задания № 1
|
№ за- да- ния |
Исследование 2 |
||||||
|
Фактический состав газовой смеси, Об. % |
Общее давление (Робщ), кПа |
Темпе- ратура, К |
|||||
|
Компоненты |
|||||||
|
A |
B |
C |
D |
E |
|||
|
10 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
|
1 |
- |
40 |
- |
60 |
- |
202,6 |
480 |
|
2 |
- |
50 |
- |
50 |
- |
101,3 |
500 |
|
3 |
- |
30 |
- |
70 |
- |
152,0 |
720 |
|
4 |
- |
50 |
- |
50 |
- |
101,3 |
300 |
|
5 |
- |
25 |
- |
75 |
- |
202,6 |
1700 |
|
6 |
- |
60 |
- |
40 |
- |
152,0 |
1400 |
|
7 |
- |
50 |
25 |
25 |
- |
101,3 |
750 |
|
8 |
- |
70 |
- |
30 |
- |
152,0 |
850 |
|
9 |
- |
75 |
- |
25 |
- |
152,0 |
650 |
|
10 |
- |
50 |
- |
50 |
- |
101,3 |
750 |
|
11 |
- |
17 |
- |
83 |
- |
101,3 |
1000 |
|
12 |
- |
50 |
- |
50 |
- |
303,9 |
750 |
|
13 |
- |
25 |
- |
75 |
- |
202,6 |
1650 |
|
14 |
- |
30 |
- |
70 |
- |
50,7 |
1350 |
|
15 |
- |
35 |
- |
65 |
- |
302,9 |
750 |
|
16 |
- |
45 |
- |
55 |
- |
202,6 |
650 |
|
17 |
- |
55 |
- |
45 |
- |
101,3 |
650 |
|
18 |
- |
65 |
- |
35 |
- |
50,7 |
1810 |
|
19 |
- |
75 |
- |
25 |
- |
10,1 |
1150 |
|
20 |
- |
85 |
- |
15 |
- |
302,9 |
1070 |
|
21 |
- |
40 |
- |
60 |
- |
10,1 |
1080 |
|
22 |
- |
50 |
- |
50 |
- |
50,7 |
1170 |
|
23 |
- |
55 |
- |
45 |
- |
303,9 |
880 |
|
24 |
- |
10 |
- |
- |
90 |
152,0 |
1480 |
|
25 |
- |
30 |
- |
70 |
- |
152,0 |
550 |
Исходные данные для выполнения
|
№ варианта |
№ задания |
Исследование 1 |
||||||
|
Схема реакции: aA + bB = cC + dD + eE |
Температурный интервал, К |
Шаг по темпе-ратуре |
||||||
|
Компоненты |
||||||||
|
A |
B |
C |
D |
E |
||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
|
2 |
1 |
AsBr3(тв) |
Н2(газ) |
As(тв) |
HBr(газ) |
- |
300 - 440 |
20 |
|
2 |
AgF(тв) |
Н2(газ) |
Ag(тв) |
HF(газ) |
- |
400 - 700 |
50 |
|
|
3 |
BBr2(тв) |
Н2(газ) |
B(тв) |
HBr(газ) |
- |
400 - 900 |
100 |
|
|
4 |
BiBr3(тв) |
Н2(газ) |
Bi(тв) |
HBr(газ) |
- |
510 - 540 |
5 |
|
|
5 |
Ce2O3(тв) |
Cl2(газ) |
CeCl3(тв) |
O2(газ) |
- |
700 -1050 |
50 |
|
|
6 |
La2O3(тв) |
Cl2(газ) |
LaCl3(тв) |
O2(газ) |
- |
600 -1100 |
100 |
|
|
7 |
Re2O3(тв) |
Cl2(газ) |
ReCl3(тв) |
O2(газ) |
- |
320 - 420 |
20 |
|
|
8 |
V2O5(тв) |
Cl2(газ) |
VCl2(тв) |
O2(газ) |
- |
600 - 900 |
50 |
|
|
9 |
SiC(тв) |
O2(газ) |
Si(тв) |
CO(газ) |
- |
1350 - 1600 |
50 |
|
|
10 |
CuS(тв) |
O2(газ) |
Cu(тв) |
SO3(газ) |
- |
600 - 1300 |
100 |
|
|
11 |
ZnS(тв) |
O2(газ) |
Zn(тв) |
SO3(газ) |
- |
450 - 700 |
50 |
|
|
12 |
TiC(тв) |
O2(газ) |
Ti(тв) |
CO2(газ) |
- |
900 - 1200 |
50 |
|
|
13 |
Ca3(PO4)2(тв) |
CO(газ) |
CaO(тв) |
P2(газ) |
CO2(газ) |
800 - 1400 |
100 |
|
|
14 |
MgSiO3(тв) |
CO(газ) |
MgO(тв) |
Si(тв) |
CO2(газ) |
1520 - 1640 |
20 |
|
|
15 |
Ca3(PO4)2(тв) |
CO(газ) |
CaO(тв) |
P4(газ) |
CO2(газ) |
800 - 2000 |
200 |
|
|
16 |
Mn2O3(тв) |
CO(газ) |
Mn3O4(тв) |
CO2(газ) |
- |
900 - 1400 |
100 |
|
|
17 |
SiC(тв) |
CO2(газ) |
Si(тв) |
CO(газ) |
- |
1400 - 1650 |
50 |
|
|
18 |
AgJ(тв) |
Н2 S(газ) |
Ag2S(тв) |
HJ(газ) |
- |
300 - 600 |
50 |
|
|
19 |
PbJ2(тв) |
HBr(газ) |
PbBr2(тв) |
HJ(газ) |
- |
300 - 600 |
50 |
|
|
20 |
SnJ4(тв) |
Н2 S(газ) |
SnS2(тв) |
HJ(газ) |
- |
300 - 380 |
10 |
|
|
21 |
CdBr2(тв) |
Н2(газ) |
Cd(тв) |
HBr(газ) |
- |
300 - 600 |
50 |
|
|
22 |
CsBr(тв) |
Н2(газ) |
Cs(тв) |
HBr(газ) |
- |
200 - 300 |
20 |
|
|
23 |
CuBr(тв) |
Н2(газ) |
Cu(тв) |
HBr(газ) |
- |
500 - 750 |
50 |
|
|
24 |
FeBr2(тв) |
Н2(газ) |
Fe(тв) |
HBr(газ) |
- |
870 - 950 |
10 |
|
|
25 |
PbJ2(тв) |
Н2(газ) |
Pb(тв) |
HJ(газ) |
- |
480 - 600 |
20 |
|
Таблица 1 (продолжение) расчетно-графического задания № 1
|
№ за- да- ния |
Исследование 2 |
||||||
|
Фактический состав газовой смеси, Об. % |
Общее давление (Робщ), кПа |
Темпе- ратура, К |
|||||
|
Компоненты |
|||||||
|
A |
B |
C |
D |
E |
|||
|
10 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
|
1 |
- |
40 |
- |
60 |
- |
10,1 |
470 |
|
2 |
- |
30 |
- |
70 |
- |
50,7 |
750 |
|
3 |
- |
20 |
- |
80 |
- |
101,3 |
950 |
|
4 |
- |
20 |
- |
90 |
- |
152,0 |
500 |
|
5 |
- |
60 |
- |
40 |
- |
202,6 |
650 |
|
6 |
- |
70 |
- |
30 |
- |
303,9 |
550 |
|
7 |
- |
80 |
- |
20 |
- |
10,1 |
450 |
|
8 |
- |
90 |
- |
10 |
- |
50,7 |
550 |
|
9 |
- |
50 |
- |
50 |
- |
101,3 |
1300 |
|
10 |
- |
45 |
- |
55 |
- |
152,0 |
1350 |
|
11 |
- |
55 |
- |
45 |
- |
202,6 |
750 |
|
12 |
- |
35 |
- |
65 |
- |
303,9 |
1250 |
|
13 |
- |
40 |
- |
30 |
30 |
10,1 |
1470 |
|
14 |
- |
40 |
- |
- |
60 |
50,7 |
1500 |
|
15 |
- |
30 |
- |
30 |
40 |
101,3 |
2100 |
|
16 |
- |
25 |
- |
75 |
- |
152,0 |
1480 |
|
17 |
- |
15 |
- |
85 |
- |
202,6 |
1350 |
|
18 |
- |
15 |
- |
85 |
- |
202,6 |
640 |
|
19 |
- |
25 |
- |
75 |
- |
303,9 |
640 |
|
20 |
- |
35 |
- |
65 |
- |
10,1 |
400 |
|
21 |
- |
10 |
- |
90 |
- |
10,1 |
650 |
|
22 |
- |
20 |
- |
80 |
- |
50,7 |
350 |
|
23 |
- |
30 |
- |
70 |
- |
101,3 |
810 |
|
24 |
- |
40 |
- |
60 |
- |
152,0 |
850 |
|
25 |
- |
50 |
- |
50 |
- |
202,6 |
450 |
Исходные данные для выполнения
|
№ варианта |
№ задания |
Исследование 1 |
||||||
|
Схема реакции: aA + bB = cC + dD + eE |
Температурный интервал, К |
Шаг по температуре |
||||||
|
Компоненты |
||||||||
|
A |
B |
C |
D |
E |
||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
|
3 |
1 |
BiF3(тв) |
Н2(газ) |
Bi(тв) |
HF(газ) |
- |
400 - 540 |
20 |
|
2 |
BiF3(тв) |
Н2(газ) |
BiF2(тв) |
HF(газ) |
- |
780 - 1000 |
50 |
|
|
3 |
CBr4(тв) |
Н2(газ) |
C(тв) |
HBr(газ) |
- |
320 - 380 |
10 |
|
|
4 |
CaBr2(тв) |
Н2(газ) |
Ca(тв) |
HBr(газ) |
- |
400 - 700 |
50 |
|
|
5 |
Y2O3(тв) |
Cl2(газ) |
YCl3(тв) |
O2(газ) |
- |
600 - 900 |
50 |
|
|
6 |
WO2(тв) |
Cl2(газ) |
WCl5(тв) |
O2(газ) |
- |
300 - 550 |
50 |
|
|
7 |
Jr2O3(тв) |
Cl2(газ) |
JrCl3(тв) |
O2(газ) |
- |
560 - 700 |
20 |
|
|
8 |
SiC(тв) |
O2(газ) |
Si(тв) |
CO(газ) |
- |
1350 - 1700 |
50 |
|
|
9 |
CaC2(тв) |
O2(газ) |
Ca(тв) |
CO(газ) |
- |
500 - 1100 |
100 |
|
|
10 |
Mn3C(тв) |
O2(газ) |
Mn(тв) |
CO(газ) |
- |
600 - 1300 |
100 |
|
|
11 |
CaC2(тв) |
O2(газ) |
CaO(тв) |
CO(газ) |
- |
400 - 700 |
50 |
|
|
12 |
PbS(тв) |
O2(газ) |
Pb(тв) |
SO3(газ) |
- |
460 - 600 |
20 |
|
|
13 |
B2O3(тв) |
CO(газ) |
B(тв) |
CO2(газ) |
- |
460 - 600 |
20 |
|
|
14 |
V2O3(тв) |
CO(газ) |
V(тв) |
CO2(газ) |
- |
1860 - 2000 |
20 |
|
|
15 |
TiO2(тв) |
CO(газ) |
Ti(тв) |
CO2(газ) |
- |
980 - 1120 |
20 |
|
|
16 |
V2O5(тв) |
CO(газ) |
V2O3(тв) |
CO2(газ) |
- |
700 - 1000 |
50 |
|
|
17 |
CaBr2(тв) |
Н2O(газ) |
CaO(тв) |
HBr(газ) |
- |
400 - 1000 |
100 |
|
|
18 |
CdBr2(тв) |
Н2O(газ) |
CdO(тв) |
HBr(газ) |
- |
300 - 900 |
100 |
|
|
19 |
BiBr3(тв) |
НCl(газ) |
BiCl3(тв) |
HBr(газ) |
- |
350 - 430 |
10 |
|
|
20 |
BiF3(тв) |
НCl(газ) |
BiCl3(тв) |
HF(газ) |
- |
410 - 500 |
10 |
|
|
21 |
PbJ2(тв) |
Н2 S(газ) |
PbS(тв) |
HJ(газ) |
- |
500 - 640 |
20 |
|
|
22 |
CaBr2(тв) |
Н2 S(газ) |
CaS(тв) |
HBr(газ) |
- |
400 - 1100 |
100 |
|
|
23 |
CdBr2(тв) |
Н2 S(газ) |
CdS(тв) |
HBr(газ) |
- |
400 - 750 |
50 |
|
|
24 |
PbJ2(тв) |
Н2O(газ) |
PbO(тв) |
HJ(газ) |
- |
480 - 600 |
20 |
|
|
25 |
SnJ4(тв) |
Н2O(газ) |
SnO2(тв) |
HJ(газ) |
- |
330 - 400 |
10 |
|
Таблица 1 (продолжение) расчетно-графического задания № 1
|
№ за- да- ния |
Исследование 2 |
||||||
|
Фактический состав газовой смеси, Об. % |
Общее давление (Робщ), кПа |
Темпе- ратура, К |
|||||
|
Компоненты |
|||||||
|
A |
B |
C |
D |
E |
|||
|
10 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
|
1 |
- |
10 |
- |
90 |
- |
302,9 |
600 |
|
2 |
- |
20 |
- |
80 |
- |
202,6 |
750 |
|
3 |
- |
30 |
- |
70 |
- |
101,3 |
440 |
|
4 |
- |
40 |
- |
60 |
- |
50,7 |
740 |
|
5 |
- |
50 |
- |
50 |
- |
10,1 |
930 |
|
6 |
- |
60 |
- |
40 |
- |
302,9 |
600 |
|
7 |
- |
70 |
- |
30 |
- |
202,6 |
500 |
|
8 |
- |
80 |
- |
20 |
- |
101,3 |
1300 |
|
9 |
- |
90 |
- |
10 |
- |
50,7 |
1170 |
|
10 |
- |
25 |
- |
75 |
- |
10,1 |
1340 |
|
11 |
- |
35 |
- |
65 |
- |
302,9 |
750 |
|
12 |
- |
45 |
- |
55 |
- |
202,6 |
650 |
|
13 |
- |
55 |
- |
45 |
- |
101,3 |
650 |
|
14 |
- |
65 |
- |
35 |
- |
50,7 |
1810 |
|
15 |
- |
75 |
- |
25 |
- |
10,1 |
1150 |
|
16 |
- |
85 |
- |
15 |
- |
302,9 |
1070 |
|
17 |
- |
35 |
- |
65 |
- |
50,7 |
1040 |
|
18 |
- |
45 |
- |
55 |
- |
101,3 |
950 |
|
19 |
- |
55 |
- |
45 |
- |
152,0 |
470 |
|
20 |
- |
65 |
- |
35 |
- |
202,6 |
540 |
|
21 |
- |
15 |
- |
85 |
- |
303,9 |
700 |
|
22 |
- |
25 |
- |
75 |
- |
10,1 |
1150 |
|
23 |
- |
30 |
- |
70 |
- |
50,7 |
800 |
|
24 |
- |
35 |
- |
65 |
- |
50,7 |
650 |
|
25 |
- |
45 |
- |
55 |
- |
101,3 |
440 |
Исходные данные для выполнения
|
№ варианта |
№ задания |
Исследование 1 |
||||||
|
Схема реакции: aA + bB = cC + dD + eE |
Температурный интервал, К |
Шаг по темпе-ратуре |
||||||
|
Компоненты |
||||||||
|
A |
B |
C |
D |
E |
||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
|
4 |
1 |
CdBr2(тв) |
Н2(газ) |
Cd(тв) |
HBr(газ) |
- |
300 - 600 |
50 |
|
2 |
CsBr(тв) |
Н2(газ) |
Cs(тв) |
HBr(газ) |
- |
200 - 300 |
20 |
|
|
3 |
CuBr(тв) |
Н2(газ) |
Cu(тв) |
HBr(газ) |
- |
500 - 750 |
50 |
|
|
4 |
FeBr2(тв) |
Н2(газ) |
Fe(тв) |
HBr(газ) |
- |
870 - 950 |
10 |
|
|
5 |
PbJ2(тв) |
Н2(газ) |
Pb(тв) |
HJ(газ) |
- |
480 - 600 |
20 |
|
|
6 |
SnJ4(тв) |
Н2(газ) |
Sn(тв) |
HJ(газ) |
- |
280 - 400 |
20 |
|
|
7 |
TiJ4(тв) |
Н2(газ) |
Ti(тв) |
HJ(газ) |
- |
280 - 400 |
20 |
|
|
8 |
CuS(тв) |
O2(газ) |
Cu(тв) |
SO3(газ) |
- |
280 - 400 |
20 |
|
|
9 |
PbS(тв) |
O2(газ) |
Pb(тв) |
SO3(газ) |
- |
800 - 1300 |
100 |
|
|
10 |
V2O3(тв) |
CO(газ) |
V(тв) |
CO2(газ) |
- |
480 - 600 |
20 |
|
|
11 |
Nb2O5(тв) |
CO(газ) |
NbO(тв) |
CO2(газ) |
- |
650 - 950 |
50 |
|
|
12 |
Al2O3(тв) |
CO(газ) |
Al(тв) |
CO2(газ) |
- |
450 - 700 |
50 |
|
|
13 |
MnO(тв) |
H2(газ) |
Mn(тв) |
Н2O(газ) |
- |
300 - 900 |
100 |
|
|
14 |
B2O3(тв) |
Cl2(газ) |
BCl3(тв) |
O2(газ) |
- |
650 - 850 |
25 |
|
|
15 |
ZnO(тв) |
HCl(газ) |
ZnCl2(тв) |
Н2O (газ) |
- |
300 - 500 |
50 |
|
|
16 |
CuCl2(тв) |
H2(газ) |
Cu(тв) |
HCl(газ) |
- |
300 - 600 |
25 |
|
|
17 |
CdO(тв) |
CO(газ) |
Cd(тв) |
CO2(газ) |
- |
300 - 600 |
50 |
|
|
18 |
CaCl2(тв) |
Н2O(газ) |
CaO(тв) |
HCl(газ) |
- |
500 - 1000 |
100 |
|
|
19 |
SiC(тв) |
Н2O(газ) |
Si(тв) |
CO2(газ) |
Н2(газ) |
1400 - 1700 |
50 |
|
|
20 |
PbS(тв) |
Н2O(газ) |
Pb(тв) |
Н2(газ) |
SO2(газ) |
480 - 600 |
20 |
|
|
21 |
CaC2(тв) |
Н2O(газ) |
CaO(тв) |
Н2(газ) |
CO(газ) |
480 - 600 |
20 |
|
|
22 |
FeBr2(тв) |
HCl(газ) |
FeCl2(тв) |
HBr(газ) |
- |
300 - 900 |
100 |
|
|
23 |
PbJ2(тв) |
HCl(газ) |
PbCl2(тв) |
HJ(газ) |
- |
450 - 700 |
50 |
|
|
24 |
CdBr2(тв) |
HCl(газ) |
CdCl2(тв) |
HBr(газ) |
- |
770 - 830 |
10 |
|
|
25 |
CaBr2(тв) |
HCl(газ) |
CaCl2(тв) |
HBr(газ) |
- |
900 - 1020 |
20 |
|
Таблица 1 (продолжение) расчетно-графического задания № 1
|
№ за- да- ния |
Исследование 2 |
||||||
|
Фактический состав газовой смеси, Об. % |
Общее давление (Робщ), кПа |
Темпе- ратура, К |
|||||
|
Компоненты |
|||||||
|
A |
B |
C |
D |
E |
|||
|
10 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
|
1 |
- |
10 |
- |
90 |
- |
10,1 |
650 |
|
2 |
- |
20 |
- |
80 |
- |
50,7 |
350 |
|
3 |
- |
30 |
- |
70 |
- |
101,3 |
810 |
|
4 |
- |
40 |
- |
60 |
- |
152,0 |
850 |
|
5 |
- |
50 |
- |
50 |
- |
202,6 |
450 |
|
6 |
- |
60 |
- |
40 |
- |
303,9 |
450 |
|
7 |
- |
70 |
- |
30 |
- |
10,1 |
450 |
|
8 |
- |
80 |
- |
20 |
- |
50,7 |
450 |
|
9 |
- |
90 |
- |
10 |
- |
101,3 |
1340 |
|
10 |
- |
15 |
- |
85 |
- |
152,0 |
450 |
|
11 |
- |
25 |
- |
75 |
- |
202,6 |
990 |
|
12 |
- |
50 |
- |
50 |
- |
303,9 |
750 |
|
13 |
- |
60 |
- |
40 |
- |
202,6 |
500 |
|
14 |
- |
50 |
- |
50 |
- |
101,3 |
670 |
|
15 |
- |
25 |
- |
75 |
- |
101,3 |
460 |
|
16 |
- |
10 |
- |
90 |
- |
152,0 |
580 |
|
17 |
- |
17 |
- |
83 |
- |
202,6 |
470 |
|
18 |
- |
20 |
- |
80 |
- |
303,9 |
740 |
|
19 |
- |
20 |
- |
50 |
30 |
10,1 |
1360 |
|
20 |
- |
20 |
- |
30 |
50 |
50,7 |
640 |
|
21 |
- |
30 |
- |
15 |
55 |
101,3 |
640 |
|
22 |
- |
35 |
- |
65 |
- |
152,0 |
970 |
|
23 |
- |
45 |
- |
55 |
- |
202,6 |
750 |
|
24 |
- |
55 |
- |
45 |
- |
303,9 |
880 |
|
25 |
- |
65 |
- |
35 |
- |
10,1 |
1050 |
Исходные данные для выполнения
|
№ варианта |
№ задания |
Исследование 1 |
||||||
|
Схема реакции: aA + bB = cC + dD + eE |
Температурный интервал, К |
Шаг по темпе-ратуре |
||||||
|
Компоненты |
||||||||
|
A |
B |
C |
D |
E |
||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
|
5 |
1 |
NbO2(тв) |
Н2(газ) |
NbO(тв) |
Н2O(газ) |
- |
750 - 1050 |
50 |
|
2 |
TiO2(тв) |
Н2(газ) |
Ti(тв) |
Н2O(газ) |
- |
1000 - 1140 |
20 |
|
|
3 |
CuS(тв) |
O2(газ) |
Cu(тв) |
SO3(газ) |
- |
600 - 1300 |
100 |
|
|
4 |
MgSiO3(тв) |
Н2(газ) |
MgO(тв) |
Si(тв) |
Н2O(газ) |
1520 - 1680 |
20 |
|
|
5 |
TiO2(тв) |
CO(газ) |
Ti(тв) |
CO2(газ) |
- |
980 - 1120 |
20 |
|
|
6 |
Al2O3(тв) |
CO(газ) |
Al(тв) |
CO2(газ) |
- |
350 - 900 |
50 |
|
|
7 |
AgBr(тв) |
H2(газ) |
Ag(тв) |
HBr(газ) |
- |
450 - 700 |
50 |
|
|
8 |
MnO(тв) |
H2(газ) |
Mn(тв) |
Н2O(газ) |
- |
500 - 1000 |
100 |
|
|
9 |
AgI(тв) |
H2S(газ) |
Ag2S(тв) |
HI(газ) |
- |
200 - 600 |
100 |
|
|
10 |
Bi2O3(тв) |
Cl2(газ) |
BiCl2(тв) |
O2(газ) |
- |
350 - 850 |
50 |
|
|
11 |
BaO(тв) |
Cl2(газ) |
BaCl3(тв) |
O2(газ) |
- |
300 - 550 |
50 |
|
|
12 |
La2O3(тв) |
Cl2(газ) |
LaCl3(тв) |
O2(газ) |
- |
600 -1100 |
100 |
|
|
13 |
CO(газ) |
H2O(газ) |
CO2(газ) |
Н2 (газ) |
- |
1200 - 1950 |
50 |
|
|
14 |
V2O5(тв) |
Cl2 (газ) |
VCl2 (тв) |
O2(газ) |
- |
550 - 950 |
50 |
|
|
15 |
PbI2 (тв) |
HCl (газ) |
PbCl2(тв) |
HI(газ) |
- |
450 - 800 |
50 |
|
|
16 |
PbI2(тв) |
H2S(газ) |
PbS(тв) |
HI(газ) |
- |
450 - 700 |
25 |
|
|
17 |
Mn3C(тв) |
Н2O(газ) |
Mn(тв) |
CO(газ) |
Н2(газ) |
700 - 1000 |
50 |
|
|
18 |
PbS(тв) |
Н2O(газ) |
Pb(тв) |
Н2(газ) |
SO2(газ) |
480 - 600 |
20 |
|
|
19 |
SiC(тв) |
Н2O(газ) |
Si(тв) |
CO(газ) |
Н2(газ) |
1350 - 1650 |
50 |
|
|
20 |
PbI2(тв) |
Н2O(газ) |
PbO(тв) |
HI(газ) |
- |
480 - 600 |
20 |
|
|
21 |
SnI4(тв) |
Н2O(газ) |
SnO2(тв) |
HI(газ) |
- |
330 - 400 |
10 |
|
|
22 |
FeBr2(тв) |
Н2O(газ) |
FeO(тв) |
HBr(газ) |
- |
650 - 950 |
50 |
|
|
23 |
AgBr(тв) |
Н2 S(газ) |
Ag2S(тв) |
HBr(газ) |
- |
320 - 440 |
20 |
|
|
24 |
AgI(тв) |
Н2S(газ) |
Ag2S(тв) |
HI(газ) |
- |
300 - 420 |
20 |
|
|
25 |
PbS(тв) |
O2(газ) |
Pb(тв) |
SO3(газ) |
- |
450 - 650 |
20 |
|
Таблица 1 (продолжение)
расчетно-графического задания № 1
|
№ за- да- ния |
Исследование 2 |
||||||
|
Фактический состав газовой смеси, Об. % |
Общее давление (Робщ), кПа |
Темпе- ратура, К |
|||||
|
Компоненты |
|||||||
|
A |
B |
C |
D |
E |
|||
|
10 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
|
1 |
- |
40 |
- |
60 |
- |
10,1 |
1080 |
|
2 |
- |
50 |
- |
50 |
- |
50,7 |
1170 |
|
3 |
- |
45 |
- |
55 |
- |
152,0 |
1350 |
|
4 |
- |
10 |
- |
- |
90 |
152,0 |
1480 |
|
5 |
- |
75 |
- |
25 |
- |
10,1 |
1150 |
|
6 |
- |
85 |
- |
15 |
- |
303,9 |
650 |
|
7 |
- |
30 |
- |
70 |
- |
152,0 |
670 |
|
8 |
- |
20 |
- |
80 |
- |
101,3 |
900 |
|
9 |
- |
15 |
- |
85 |
- |
101,3 |
500 |
|
10 |
- |
75 |
- |
25 |
- |
152,0 |
790 |
|
11 |
- |
50 |
- |
50 |
- |
202,6 |
540 |
|
12 |
- |
70 |
- |
30 |
- |
303,9 |
550 |
|
13 |
20 |
30 |
15 |
35 |
- |
101,3 |
1300 |
|
14 |
- |
90 |
- |
10 |
- |
50,7 |
930 |
|
15 |
- |
45 |
- |
55 |
- |
101,3 |
650 |
|
16 |
- |
65 |
- |
35 |
- |
152,0 |
550 |
|
17 |
- |
20 |
- |
50 |
30 |
202,6 |
1050 |
|
18 |
- |
20 |
- |
30 |
50 |
303,9 |
450 |
|
19 |
- |
30 |
- |
15 |
55 |
10,1 |
1300 |
|
20 |
- |
35 |
- |
65 |
- |
50,7 |
650 |
|
21 |
- |
45 |
- |
55 |
- |
101,3 |
440 |
|
22 |
- |
55 |
- |
45 |
- |
152,0 |
1000 |
|
23 |
- |
65 |
- |
35 |
- |
202,6 |
480 |
|
24 |
- |
15 |
- |
85 |
- |
303,9 |
450 |
|
25 |
- |
90 |
- |
10 |
- |
101,3 |
540 |
Исходные данные для выполнения
|
№ варианта |
№ задания |
Исследование 1 |
||||||
|
Схема реакции: aA + bB = cC + dD + eE |
Температурный интервал, К |
Шаг по темпе-ратуре |
||||||
|
Компоненты |
||||||||
|
A |
B |
C |
D |
E |
||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
|
6 |
1 |
V2O5(тв) |
Н2(газ) |
V2O3(тв) |
Н2O(газ) |
- |
650 - 900 |
50 |
|
2 |
N2O4(газ) |
- |
NO2 (газ) |
- |
- |
500 - 1200 |
100 |
|
|
3 |
C(тв) |
Н2O(газ) |
CO2(газ) |
Н2(газ) |
- |
300 - 1200 |
100 |
|
|
4 |
FeO(тв) |
Н2 (газ) |
Fe (тв) |
Н2O(газ) |
- |
700 - 1000 |
50 |
|
|
5 |
ZnS(тв) |
O2 (газ) |
Zn(тв) |
CO3(газ) |
- |
450 - 700 |
50 |
|
|
6 |
Cr2O3(тв) |
Cl2(газ) |
CrCl3(тв) |
O2(газ) |
- |
300 - 700 |
100 |
|
|
7 |
AgF(тв) |
H2(газ) |
Ag(тв) |
HF(газ) |
- |
450 - 750 |
50 |
|
|
8 |
V2O5(тв) |
CO(газ) |
V(тв) |
CO2(газ) |
- |
450 - 1050 |
100 |
|
|
9 |
AlCl3(тв) |
H2(газ) |
Al(тв) |
HCl(газ) |
- |
320 - 600 |
50 |
|
|
10 |
PCl3(газ) |
Cl2(газ) |
PCl5(газ) |
- |
- |
400 - 1000 |
100 |
|
|
11 |
Ti(тв) |
CO2(газ) |
TiO2(тв) |
CO(газ) |
- |
850 - 1350 |
100 |
|
|
12 |
V2O5(тв) |
H2(газ) |
V2O3(тв) |
Н2O(газ) |
- |
650 - 950 |
50 |
|
|
13 |
Mn3C(тв) |
Н2O(газ) |
Mn(тв) |
CO2(газ) |
Н2(газ) |
650 - 950 |
50 |
|
|
14 |
CaBr2(тв) |
Н2O(газ) |
CaO(тв) |
HBr(газ) |
- |
400 - 1000 |
100 |
|
|
15 |
CdBr2(тв) |
Н2O(газ) |
CdO(тв) |
HBr(газ) |
- |
300 - 900 |
100 |
|
|
16 |
BiBr3(тв) |
НCl(газ) |
BiCl3(тв) |
HBr(газ) |
- |
350 - 430 |
10 |
|
|
17 |
BiF3(тв) |
НCl(газ) |
BiCl3(тв) |
HF(газ) |
- |
410 - 500 |
10 |
|
|
18 |
PbJ2(тв) |
Н2 S(газ) |
PbS(тв) |
HJ(газ) |
- |
500 - 640 |
20 |
|
|
19 |
CaBr2(тв) |
Н2 S(газ) |
CaS(тв) |
HBr(газ) |
- |
400 - 1100 |
100 |
|
|
20 |
CdBr2(тв) |
Н2 S(газ) |
CdS(тв) |
HBr(газ) |
- |
400 - 750 |
50 |
|
|
21 |
SiC(тв) |
Н2O(газ) |
Si(тв) |
CO(газ) |
Н2(газ) |
1350 -1650 |
50 |
|
|
22 |
AgJ(тв) |
Н2O(газ) |
Ag2O(тв) |
HI(газ) |
- |
320 - 440 |
20 |
|
|
23 |
PbJ2(тв) |
Н2O(газ) |
PbO(тв) |
HI(газ) |
- |
450 - 750 |
50 |
|
|
24 |
FeBr2(тв) |
Н2O(газ) |
FeO(тв) |
HBr(газ) |
- |
870 - 950 |
10 |
|
|
25 |
AgI(тв) |
H2S(газ) |
Ag2S(тв) |
HI (газ) |
- |
300 - 600 |
50 |
|
Таблица 1 (продолжение)
расчетно-графического задания № 1
|
№ за- да- ния |
Исследование 2 |
||||||
|
Фактический состав газовой смеси, Об. % |
Общее давление (Робщ), кПа |
Темпе- ратура, К |
|||||
|
Компоненты |
|||||||
|
A |
B |
C |
D |
E |
|||
|
10 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
|
1 |
- |
75 |
- |
25 |
- |
10,1 |
950 |
|
2 |
80 |
- |
20 |
- |
- |
101,3 |
950 |
|
3 |
- |
20 |
- |
30 |
50 |
101,3 |
640 |
|
4 |
- |
30 |
- |
70 |
- |
152,0 |
860 |
|
5 |
- |
55 |
- |
45 |
- |
202,6 |
660 |
|
6 |
- |
50 |
- |
50 |
- |
101,3 |
750 |
|
7 |
- |
30 |
- |
70 |
- |
50,7 |
600 |
|
8 |
- |
70 |
- |
30 |
- |
101,3 |
1000 |
|
9 |
- |
50 |
- |
50 |
- |
101,3 |
400 |
|
10 |
30 |
30 |
40 |
- |
- |
152,0 |
650 |
|
11 |
- |
20 |
- |
80 |
- |
202,6 |
1150 |
|
12 |
- |
75 |
- |
25 |
- |
303,9 |
830 |
|
13 |
- |
30 |
- |
15 |
55 |
10,1 |
990 |
|
14 |
- |
35 |
- |
65 |
- |
50,7 |
1040 |
|
15 |
- |
45 |
- |
55 |
- |
101,3 |
950 |
|
16 |
- |
55 |
- |
45 |
- |
152,0 |
470 |
|
17 |
- |
65 |
- |
35 |
- |
202,6 |
540 |
|
18 |
- |
15 |
- |
85 |
- |
303,9 |
700 |
|
19 |
- |
25 |
- |
75 |
- |
10,1 |
1150 |
|
20 |
- |
30 |
- |
70 |
- |
50,7 |
800 |
|
21 |
- |
15 |
- |
40 |
45 |
101,3 |
1300 |
|
22 |
- |
20 |
- |
80 |
- |
152,0 |
480 |
|
23 |
- |
30 |
- |
70 |
- |
202,6 |
800 |
|
24 |
- |
40 |
- |
60 |
- |
303,9 |
990 |
|
25 |
- |
15 |
- |
85 |
- |
152,0 |
500 |
Исходные данные для выполнения
|
№ вари анта |
№ задания |
Исследование 1 |
||||||
|
Схема реакции: aA + bB = cC + dD + eE |
Температурный интервал, К |
Шаг по темпе-ратуре |
||||||
|
Компоненты |
||||||||
|
A |
B |
C |
D |
E |
||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
|
7 |
1 |
PbJ2(тв) |
CH4(газ) |
Pb(тв) |
C(тв) |
HJ(газ) |
400-520 |
20 |
|
2 |
CdBr2(тв) |
CH4(газ) |
Cd(тв) |
C(тв) |
HBr(газ) |
380 - 600 |
20 |
|
|
3 |
AgJ(тв) |
CH4(газ) |
Ag(тв) |
C(тв) |
HJ(газ) |
320 - 400 |
10 |
|
|
4 |
SnJ4(тв) |
CH4(газ) |
Sn(тв) |
C(тв) |
HJ(газ) |
320 - 400 |
10 |
|
|
5 |
TiJ4(тв) |
CH4(газ) |
Ti(тв) |
C(тв) |
HJ(газ) |
320 - 400 |
10 |
|
|
6 |
AgF(тв) |
CH4(газ) |
Ag(тв) |
C(тв) |
HF(газ) |
400 - 700 |
50 |
|
|
7 |
AgBr(тв) |
CH4(газ) |
Ag(тв) |
C(тв) |
HBr(газ) |
400 - 700 |
50 |
|
|
8 |
PbO(тв) |
CH4(газ) |
Pb(тв) |
CO(газ) |
Н2(газ) |
300 - 600 |
50 |
|
|
9 |
NbO2(тв) |
CH4(газ) |
NbO(тв) |
CO(газ) |
Н2O(газ) |
400 - 1000 |
100 |
|
|
10 |
BaO(тв) |
CH4(газ) |
Ba(тв) |
CO2(газ) |
Н2O(газ) |
300 - 600 |
50 |
|
|
11 |
Cu2O(тв) |
CH4(газ) |
Cu(тв) |
CO(газ) |
Н2(газ) |
650 - 1350 |
100 |
|
|
12 |
MnO(тв) |
CH4(газ) |
Mn(тв) |
CO(газ) |
Н2(газ) |
400 - 1000 |
100 |
|
|
13 |
NbO2(тв) |
CH4(газ) |
NbO(тв) |
CO(газ) |
Н2(газ) |
400 - 1000 |
100 |
|
|
14 |
TiO(тв) |
C2H2(газ) |
Ti(тв) |
CO2(газ) |
Н2(газ) |
400 - 1000 |
100 |
|
|
15 |
NbO2(тв) |
C2H2(газ) |
NbO(тв) |
CO(газ) |
Н2O(газ) |
400 - 1000 |
100 |
|
|
16 |
Cu2O(тв) |
C2H2(газ) |
Cu(тв) |
CO2(газ) |
Н2O(газ) |
700 - 1300 |
100 |
|
|
17 |
CuBr(тв) |
C2H2(газ) |
Cu(тв) |
C(тв) |
HBr(газ) |
400 -700 |
50 |
|
|
18 |
FeBr2(тв) |
C2H2(газ) |
Fe(тв) |
C(тв) |
HBr(газ) |
300 - 900 |
100 |
|
|
19 |
TiBr4(тв) |
C2H2(газ) |
Ti(тв) |
C(тв) |
HBr(газ) |
230 - 300 |
10 |
|
|
20 |
CdBr2(тв) |
C2H2(газ) |
Cd(тв) |
C(тв) |
HBr(газ) |
300 - 600 |
50 |
|
|
21 |
AgF(тв) |
C2H2(газ) |
Ag(тв) |
C(тв) |
HF(газ) |
400 - 700 |
50 |
|
|
22 |
AgBr(тв) |
C2H2(газ) |
Ag(тв) |
C(тв) |
HBr(газ) |
400 - 700 |
50 |
|
|
23 |
AgJ(тв) |
Н2 S(газ) |
Ag2S(тв) |
HJ(газ) |
- |
300 - 600 |
50 |
|
|
24 |
PbJ2(тв) |
HBr(газ) |
PbBr2(тв) |
HJ(газ) |
- |
300 - 600 |
50 |
|
|
25 |
SnJ4(тв) |
Н2 S(газ) |
SnS2(тв) |
HJ(газ) |
- |
300 - 380 |
10 |
|
Таблица 1 (окончание) расчетно-графического задания № 1
|
№ за- да- ния |
Исследование 2 |
||||||
|
Фактический состав газовой смеси, Об. % |
Общее давление (Робщ), кПа |
Темпе- ратура, К |
|||||
|
Компоненты |
|||||||
|
A |
B |
C |
D |
E |
|||
|
10 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
|
1 |
- |
10 |
- |
- |
90 |
10,1 |
550 |
|
2 |
- |
20 |
- |
- |
80 |
50,7 |
640 |
|
3 |
- |
30 |
- |
- |
70 |
101,3 |
440 |
|
4 |
- |
40 |
- |
- |
60 |
152,0 |
440 |
|
5 |
- |
50 |
- |
- |
50 |
202,6 |
440 |
|
6 |
- |
60 |
- |
- |
40 |
303,9 |
750 |
|
7 |
- |
70 |
- |
- |
30 |
10,1 |
750 |
|
8 |
- |
20 |
- |
50 |
30 |
50,7 |
660 |
|
9 |
- |
20 |
- |
30 |
50 |
101,3 |
1050 |
|
10 |
- |
30 |
- |
15 |
55 |
152,0 |
650 |
|
11 |
- |
20 |
- |
50 |
30 |
202,6 |
1400 |
|
12 |
- |
20 |
- |
30 |
50 |
303,9 |
1050 |
|
13 |
- |
30 |
- |
15 |
55 |
10,1 |
1050 |
|
14 |
- |
40 |
- |
30 |
30 |
50,7 |
1040 |
|
15 |
- |
30 |
- |
40 |
30 |
101,3 |
1040 |
|
16 |
- |
20 |
- |
40 |
40 |
152,0 |
680 |
|
17 |
- |
15 |
- |
- |
85 |
202,6 |
750 |
|
18 |
- |
25 |
- |
- |
75 |
303,9 |
940 |
|
19 |
- |
35 |
- |
- |
65 |
10,1 |
320 |
|
20 |
- |
45 |
- |
- |
55 |
50,7 |
640 |
|
21 |
- |
55 |
- |
- |
45 |
101,3 |
750 |
|
22 |
- |
65 |
- |
- |
35 |
152,0 |
750 |
|
23 |
- |
15 |
- |
85 |
- |
202,6 |
640 |
|
24 |
- |
25 |
- |
75 |
- |
303,9 |
640 |
|
25 |
- |
35 |
- |
65 |
- |
10,1 |
400 |
3. ПРИМЕР РЕШЕНИЯ ЗАДАНИЯ
В начале расчёта необходимо переписать формулировку задания (п.1), вписывая вместо многоточия исходные данные, взятые из табл.1. После подстановки стехиометрических коэффициентов (см. задание 26 в варианте 1) уравнение реакции примет вид:
FeS(тв)+2HCl(г) = FeCl2(тв)+H2S(г)
3.1. Исследование 1
Для удобства последующих расчетов составляем таблицу исходных данных, используя справочный материал[1 – 3].
Таблица 2
Исходные данные для термодинамического исследования реакции:
FeS + 2HCl = FeCl2 + H2S
|
N0_ п\п |
Вещество |
ΔH0298, кДж/моль |
S0298, Дж/моль*К |
Коэффициенты в уравнение a+bT+c’T-2, Дж/моль*К |
||
|
а |
b*103 |
c’*10-5 |
||||
|
1 |
FeS |
-96460 |
67,41 |
21,73 |
110,35 |
0 |
|
2 |
HCl |
-92300 |
186,6 |
26,5 |
4,6 |
1,09 |
|
3 |
FeCl2 |
-342900 |
129,2 |
79,3 |
8,71 |
0 |
|
4 |
H2S |
-20100 |
205,5 |
29,37 |
15,38 |
0 |
3.1.1. Расчет изменения изобарной теплоемкости (![]() ) и теплового эффекта реакции (
) и теплового эффекта реакции (![]() )
)
Зависимость теплового эффекта реакции от температуры определяется законом Кирхгофа:
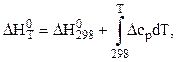 (1)
(1)
где:
![]() – стандартный тепловой эффект реакции при
298 К;
– стандартный тепловой эффект реакции при
298 К;
![]() -
изменение теплоёмкости системы в результате протекания реакции.
-
изменение теплоёмкости системы в результате протекания реакции.
Последняя величина рассчитывается по уравнению:
![]() (2)
(2)
где ![]() - мольная
изобарная теплоёмкость i-го вещества, определяемая из уравнения:
- мольная
изобарная теплоёмкость i-го вещества, определяемая из уравнения:
![]() (3)
(3)
ni – стехиометрический коэффициент i-го вещества в уравнении реакции.
Для исследуемой реакции, после подстановки в уравнение (2) ni, оно примет вид:
![]() (4)
(4)
Определим температурные зависимости Сp,i для всех реагентов, используя уравнение (2) и термодинамические данные в табл.2:
![]() (5a)
(5a)
![]() (5b)
(5b)
![]() (5c)
(5c)
![]() (5d)
(5d)
Определим расчетные уравнения ![]() =
f(T) для исследуемой реакции
=
f(T) для исследуемой реакции
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.