Р. Ельдерфільдом і А. А. Пономарьовим були зроблені спроби узагальнити весь наявний матеріал по орієнтуючому впливу замісників у фурановому ядрі, однак єдиний висновок, який вони зробили-це переважна орієнтація в положення 2. Як указує Пономарьов, в цьому процесі важко знайти які-небудь правила, подібні існуючим для бензольного ядра, вже постільки, оскільки сама структура фуранового цикла, в якій гетероатом кисню здійснює значний вплив на всі реакції, що відбуваються зі спряженою системою подвійних зв'язків цикла, не відкриває тих можливостей, які є у бензолу. А. Ремік зробив спробу пояснити електронний механізм орієнтації в фурановому кільці. Він відмічає, що переважне заміщення в положенні 5 фуранового цикла, що відбувається незалежно від хімічної природи вже існуючого в положенні 2 замісника, може бути пояснене електронними зміщеннями в молекулі, як це видно на прикладі:
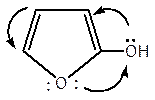
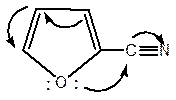
В обох випадках, незважаючи на наявність замісників як першого, так і другого ряду, активується положення 5 фуранового ядра.
Загальний висновок, який робить Пономарьов із розглянутих реакцій заміщення у фурановому циклі, заключається в тому, що ці реакції у фурана і його похідних протікають, в загальному, легше, ніж у бензолу, і в багатьох випадках можуть бути співставлені з аналогічними у ненасичених сполук аліфатичного ряду.
1.1.3 Реакції атома кисню фуранового гетероцикла
Серед реакцій гетероатома кисню фуранових сполук розрізняють три основних типи реакцій: заміщення гетероатома кисню на –NH-, -S- і -Se-; розкриття фуранового кільця з утворенням сполук жирного ряду і утворення шестичленних гетеро- чи карбоциклічних речовин.
Реакції заміщення кисневого гетероатома на –NH–, –S– і –Se– відкриті у 1935 р. Юр'євим
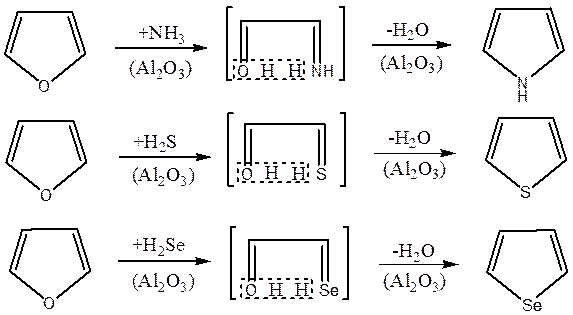
Цей каталітичний процес, детально вивчений Юр'євим зі співробітниками, має важливе значення для хімії гетероциклічних сполук взагалі і хімії фуранових сполук зокрема, так як він дозволяє встановити генетичний зв'язок між п'ятичленними гетероциклами і виявити роль фурану як основної речовини в утворенні похідних піролу у природі.
Можливість взаємного перетворення п'ятичленних гетероциклів один в одного відкрило широкі перспективи в області синтезу мономерних і полімерних продуктів гетероциклічного ряду.
1.1.4 Реакції розкриття фуранового циклу
Розкриття циклу зазнають фуранові альдегіди під впливом ароматичних амінів в присутності мінеральної кислоти. При цьому утворюються поліметинові барвники й піридинові похідні. Так, наприклад, під впливом суміші аніліну з солянокислим аніліном фурфурол зазнає перетворення:
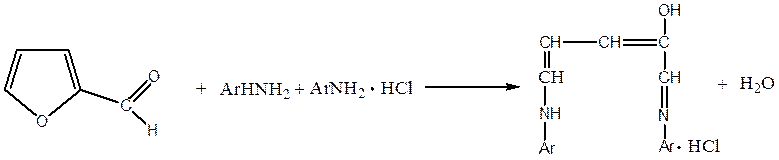
Послідуючі реакції можуть призвести до циклізації з утворенням піридинового кільця. Ці реакції без сумніву мають місце в складному процесі утворення аніліно-фурфурольних смол.
Під впливом окисників фурановий цикл розкривається з утворенням в багатьох випадках ациклічних сполук. Окиснення фурану киснем повітря дає малеїновий ангідрид. При окисненні фурфуролу з високим виходом утворюється малеїнова кислота.
Розщеплення фуранового кільця може відбуватися також і під впливом водню (гідрогеноліз), що помічається при проведенні каталітичного гідрування в жорстких умовах.
Розглядаючи реакцію гетероциклічного кисню і реакції розкриття фуранового кільця, А. А. Пономарьов зробив слідуючі узагальнюючі висновки:
1. Фуранам властива більшість звичайних для етерів реакцій.
2. Реакції ефірного зв'язку фуранового циклу, зокрема, чутливість її до гетеролітичного розщеплення в присутності йонів водню, у відомій мірі, нагадує властивості вінілових етерів.
1.2 ОСОБЛИВОСТІ МОНОМЕРНИХ ФУРАНОВИХ СПОЛУК В РЕАКЦІЯХ УТВОРЕННЯ ПОЛІМЕРІВ
Висока і різностороння реакційна здібність фуранових сполук, пов'язана з особливостями структури і поліфункціональністю фуранового ядра, створює умови для легкого протікання реакцій, що призводять до утворення полімерів. Осмоління більшості фуранових сполук спостерігається навіть в процесі їх зберігання.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.