3 ЕКСПЕРИМЕНТАЛЬНА ЧАСТИНА
3.1. Об'єкти й методи дослідження
3.1.1 Об'єкти дослідження
У якості обьектов дослідження використалися жирні кислоти соняшникового масла й олеиновая кислота, що вступають у реакції з фурфуриловым спиртом і фурфурилглицидиловым ефіром.
Фурфурилглицидиловый ефір синтезували самостійно, по раніше відомій методиці [9].
Синтез проводили в трехгорлой колбі, постаченою мішалкою, термометром і лійкою (для завантаження їдкого натру). ДО 185 м (2 молячи) эпихлоргидрина й 98,1 р. (1моль) фурфурилового спирту в 200 мол. толуолу додавали в плині 2,5 години при кімнатній температурі й перемішуванні 45 р. їдкого натру в порошку. Масу нагрівали 3 години при 70?З, після чого осад отфильтровали, фільтрат, промили водою, висушили й піддали вакуумному розгону при 4-5 мм. рт. ст.
Одержали 75,5 м ( 49 % ) ЭФУ c чистотою 96 % й 17,6 м ( 14 % ) дифурфурилглицидилового ефіру із чистотою 92 %. Очищення проводили дворазовим розгоном. Ступінь чистоти ЭФУ визначали по эпоксидному числу.
На основі ЖК соняшникового масла й ЭФУ готовили композиції, сполуку яких наведений у табл. 3.1. Перед проведенням експерименту ЖК сушили під вакуумом. Як каталізатор використали (СH3)2(PhCH2)2NFeCl4. Експеримент проводили в запаяних ампулах.
Характеристика вихідних сполук наведена в табл.3.2.
3.1.2 Методи дослідження
Зміст вільних кислот у зразках визначали за допомогою К.Ч відповідно до ДЕРЖСТАНДАРТ 5476 - 80.
Кількість эпоксидных груп розраховували по формулі (3.1) у відсотках:
Таблиця 3.1 - Сполука композицій на основі ЖК й ЭФУ
|
Позначення композиції |
Зміст ЖК, моль. |
Зміст ЭФУ, моль. |
Зміст каталізатора стосовно ЭФУ, %. |
|
К – 1:1 (к) |
1 |
1 |
1,5 |
|
К – 1:1 |
− |
||
|
К – 1:3 (к) |
3 |
1,5 |
|
|
К – 1:3 |
− |
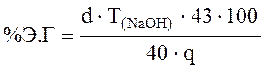 (3.1)
(3.1)
де d = (V1 – V2) – різниця між кількостями 0,1 % розчину NaOH контрольного зразка, що йде на титрування (V1) і робітника об'єму;
TNaOH – титр 0,1 % розчин NaOH;
43 - молекулярна вага эпоксигруппы;
40 - молекулярна вага NaOH;
q - навішення смоли, м.
Диференціальна сканирующая калориметрія
Диференціальний сканирующий калориметр на діатермічній оболонці (ДСК-Д) призначений для виміру величин питомої теплоємності й энтальпии при процесах кристалізації й плавлення для полімерів, що кристалізуються, і температури стеклования з відповідним стрибком теплоємності для аморфних полімерів в умовах квазістаціонарного лінійного нагрівання. У випадку дослідження хімічних перетворень із виділенням (поглинанням) тепла, можливе фіксування теплових ефектів як при скануванні зразка по температурі, так й в ізотермічних умовах [10 ].
Таблиця 3.2 - Характеристика вихідних сполук
|
Вихідні матеріали |
Нормативна документація |
Основні показники |
|
Эпихлоргидрин |
ТУ 6 – 09 – 4225 |
Зміст основної речовини - не менш 98,0 %. Температура кип'ятіння - 114 - 117 ?С. Щільність – 1,180 г/см3. Показник переломлення - 1,438. |
|
Фурфуриловый спирт |
ТУ 6 – 09 – 4159 |
Зміст основної речовини - не менш 98,0 %. Температура кипіння - 171 ?С. Щільність - 1,132. Показник переломлення - 1,486. |
|
ЖК соняшникового Масла |
Зміст основної речовини - не менш 92,0 %, середня ММ - 280,9. |
|
|
Олеиновая кислота |
ТУ 10 – 0402 – 82 – 91 |
Зміст олеиновой кислоти - 93,15 %. Йодне число – 90 м I2/100р. |
|
Толуол нафтовий |
ДЕРЖСТАНДАРТ 14710 – 95 |
Щільність при 20 ˚С – 0,866 г/см3. Межі перегонки: 98 % об'єму переганяється в межах - 0,6 ?С. |
В основу роботи калориметра покладений принцип диференціального розміщення двох пар однакових термобатарей. В одну з осередків кожної пари міститься еталонна речовина, у другу - досліджуваний зразок. Реєструючи при лінійному нагріванні корпуса тепловий потік, можна знайти значення теплових ефектів, що супроводжують перетворення в полімерах, і температурну залежність теплоємності.
Кількість теплоти, виділюваної або поглинає зразком при протіканні хімічних перетворень можна оцінити безпосередньо з термограмм:
QН = B· S, (3.2)
де B - постійна калориметра;
S - площа піка, обмеженого диференціальним записом і лінією, по якій би відбувалася зміна энтальпии під час відсутності теплового ефекту.
При визначенні постійної В у якості еталонної речовини використали бензойну кислоту, атестовану по величині теплоти плавлення.
При дослідженні
кінетичних закономірностей отверждения по тепловиділенню навішення досліджуваного зразка
бралося в кількості 0,150 ± 0,015·![]() кг. В
качестве образцов использовали модельные ОЭ и композиции на их основе.
кг. В
качестве образцов использовали модельные ОЭ и композиции на их основе.
Твердість плівок визначали на маятниковому приладі МА - 3 за ДСТ 5233- 89.
Дослідження процесу отверждения проводили в тонких плівках. Перед отверждением підкладки, з нанесеним методом наливу плівкоутворювальному, выдерживались на повітрі в плині10 хв під кутом 45( (для одержання плівок товщиною 25 ( 5мкм). Отверждение плівок здійснювали в термостатированном шафі при заданій температурі. Товщину покриттів вимірювали мікрометром відповідно до ДЕРЖСТАНДАРТ 8832 - 76.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.