Величина поверхностного натяжения растворов солей в зависимости от температуры (при отсутствии справочных данных) может быть приближенно определена по уравнению:
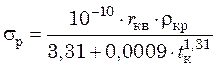 , (24.1)
, (24.1)
где ![]() –
удельная теплота парообразования воды при температуре кипения раствора, Дж/кг;
–
удельная теплота парообразования воды при температуре кипения раствора, Дж/кг; ![]() – плотность раствора при температуре
кипения, кг/м3;
– плотность раствора при температуре
кипения, кг/м3; ![]() – температура
кипения раствора, °С.
– температура
кипения раствора, °С.
Кроме перечисленных выше основных свойств, в процессах выпаривания используют такие свойства как температура кипения, теплота концентрирования, теплоты фазовых переходов (испарения, конденсации, кристаллизации). Для воды и некоторых других веществ значения теплоты фазовых переходов представлены в справочной литературе.
Температура кипения. Жидкость принято считать кипящей, когда в ее объеме образуются пузырьки пара. Закипает жидкость тогда, когда давление насыщенного пара жидкости становится равным величине внешнего давления над ее поверхностью. Давление насыщенного пара над поверхностью жидкости зависит от величины внешнего давления. Температура кипения жидкости при давлении 760 мм рт. ст. называется нормальной температурой кипения. При повышении давления температура кипения увеличивается, а при понижении – уменьшается. Более подробно вопрос определения температуры кипения раствора рассмотрен в разделе 10.4.
Теплота концентрирования. Процесс растворения или концентрирования
веществ сопровождается определенным тепловым эффектом. Теплота концентрирования
![]() выражает
тепловой эффект концентрирования раствора и равна разности интегральных теплот
растворения концентрированного и разбавленного растворов. В справочной литературе
в качестве теплоты растворения
выражает
тепловой эффект концентрирования раствора и равна разности интегральных теплот
растворения концентрированного и разбавленного растворов. В справочной литературе
в качестве теплоты растворения ![]() обычно применяется
изменение энтальпии
обычно применяется
изменение энтальпии ![]() при
растворении 1 моля вещества в большом (более 300 молей) объеме растворителя при
стандартной температуре 25 °С.
Расчет теплоты концентрирования раствора в
при
растворении 1 моля вещества в большом (более 300 молей) объеме растворителя при
стандартной температуре 25 °С.
Расчет теплоты концентрирования раствора в ![]() -м
корпусе выпарной установки производится по формуле:
-м
корпусе выпарной установки производится по формуле:
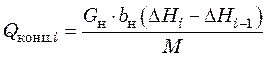 , (24.2)
, (24.2)
где ![]() –
теплота концентрирования раствора, Вт;
–
теплота концентрирования раствора, Вт; ![]() –
расход исходного раствора, кг/с;
–
расход исходного раствора, кг/с; ![]() – массовая доля
растворенного вещества в исходном растворе;
– массовая доля
растворенного вещества в исходном растворе; ![]() ,
кДж/кмоль;
,
кДж/кмоль; ![]() – молярная масса растворенного вещества,
кг/кмоль.
– молярная масса растворенного вещества,
кг/кмоль.
Теплота кристаллизации. Процесс
кристаллизации соли из раствора сопровождается тепловым эффектом, обратным по
знаку тепловому эффекту при растворении. Количество теплоты, которое выделяется
или поглощается при кристаллизации одного моля вещества, называется теплотой
кристаллизации (![]() или
или ![]() ).
).
В настоящее время наибольшее распространение получили вертикальные трубчатые выпарные аппараты с паровым обогревом, схема устройств которых представлена на рис. 24.1.
|
Рисунок 24.1 –Схема устройства
выпарного аппарата: |
В первоначальный момент аппарат заполнен холодным раствором до уровня, указанного на рис. 24.1. При подаче пара в греющую камеру 1 раствор, находящийся в трубках, начинает нагреваться. Поскольку плотность раствора с увеличением температуры уменьшается, возникает разность плотностей у раствора, который находится в трубках греющей камеры и циркуляционной трубе. Под действием этой разности плотностей раствор начинает двигаться по контуру: греющая камера 1 ® сепаратор 2 ® циркуляционная труба 3 в направлении, указанном стрелками. При движении увеличивается коэффициент теплоотдачи со стороны раствора, соответственно, увеличивается его температура, что приводит к дальнейшему возрастанию скорости потока, и так до начала кипения раствора. Начиная с момента вскипания раствора, скорость циркуляции резко возрастает, так как в трубках греющей камеры образуется паро -растворная эмульсия, плотность которой значительно меньше плотности раствора. Однако при увеличении скорости циркуляции возрастают гидравлические сопротивления, и в итоге при скорости движения порядка 1 ¸ 1,5 м/с наступает динамическое равновесие и скорость циркуляции стабилизируется.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.