1 АНАЛІТИЧНИЙ ОГЛЯД
1.1 Фуранові сполуки
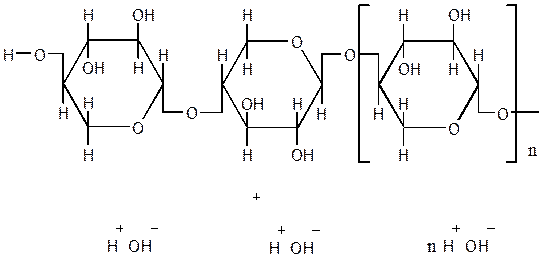
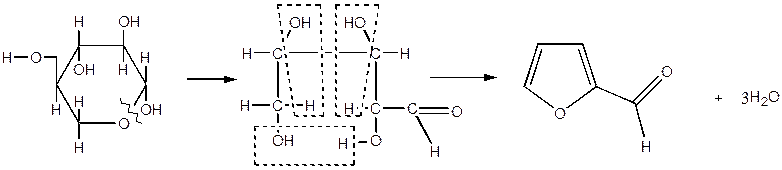
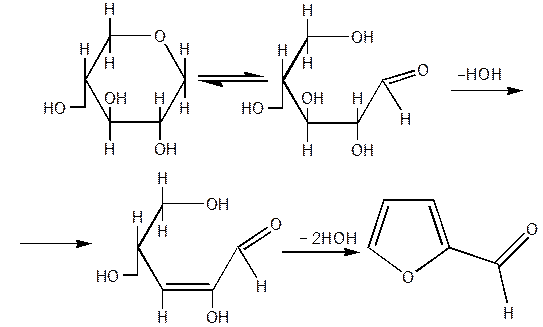
- реакції подвійних зв'язків циклу;
- реакції заміщення при вуглецевих атомах циклу;
- реакції етерної групи гєтероатома кисню;
- реакції розкриття циклу.
Відомі численні реакції, обумовлені присутністю подвійних зв'язків у фурановому циклі. Так, фуран, його алкіл- і арилгомологи й інші похідні із замісниками, що не містять безпосередньо сполучення із циклом кратних зв'язків (C = C, C = О, - NO і т.п.), утворюють із великою легкістю нормальні аддукти з малєіновим ангідридом, малеіновою кислотою, ацетілендикарбоновою кислотою і її ефірами.
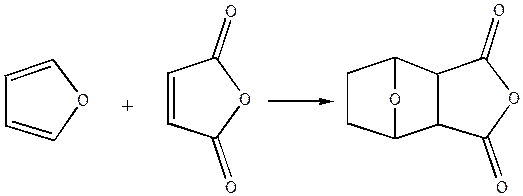
Аддукти фуранов, що утворюються при диєновому синтезі, здебільшого відрізняються малою термостійкістю, і мають схильність до дисоціації на вихідні компоненти.
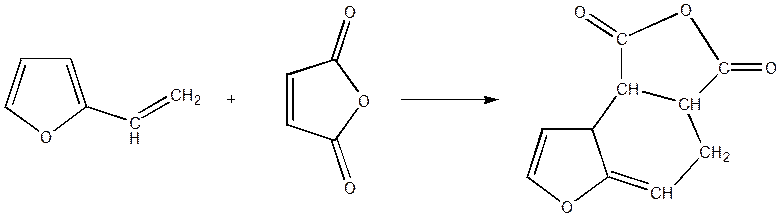
Так фуран і фуранові похідні вступають у звичайні для ароматичних сполук реакції електрофільного заміщення, причому легше бензолу.
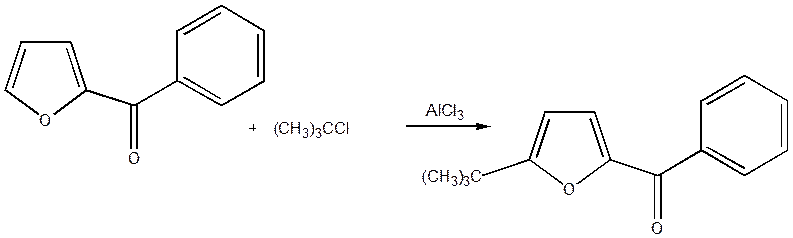
Заміщення у всіх випадках відбувається в першу чергу в α положення. Незалежно від хімічної природи вже наявного в α - положенні замісника переважне заміщення відбувається в α¢ - положенні. Це можна пояснити з погляду електронних зсувів у молекулі

І тільки якщо це положення зайняте, то заміщення йде в β або β¢ - положення [8].
Гидролітичне розщеплення фуранового циклу, як правило, відбувається дуже легко в більшості фуранових сполук, (крім утримуючих в ядрі сильні електронегативні замісники ), під впливом навіть дуже сильно розведених розчинів мінеральних кислот. Механізм реакції, що приводить у найбільш простих випадках до утворення γ - (або 1,4) дикарбонових продуктів аліфатичного ряду, найбільше чітко з'ясовується на прикладах розщеплення фурана і його гомологів:

Для випадку фурілкарбінолов запропонована нижче наступна схема перетворень [9]:
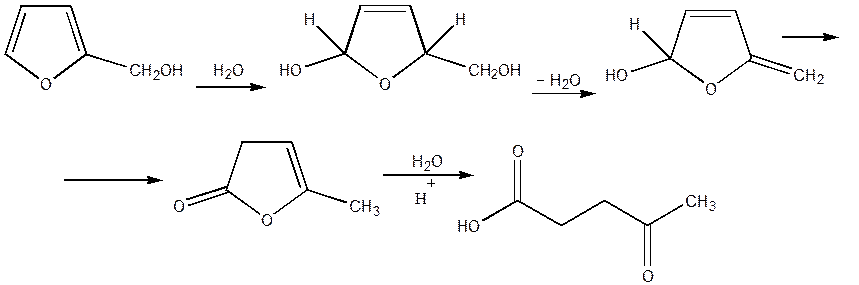
Фурановий цикл розкривається й при дії окислювачів, які судячи по всьому, спрямованіь на 1,4 - вуглецеві атоми циклу. При окислюванні фурану киснем повітря з майже кількісним виходом утвориться малєіновий ангідрид. Окиснювання фурфуролу над каталізатором з молибдата заліза дає малєїновую кислоту з виходом понад 75%
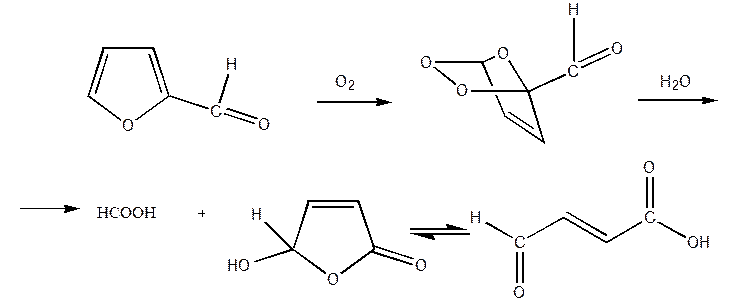
1.2 Фурфурілоксиран
Цей мономер один із молодих представників родини фурану. Цей синтез проходить в одну стадію (безпосереднє приєднання оксирану до фуранового циклу) з високим вихідом, за реакцією:
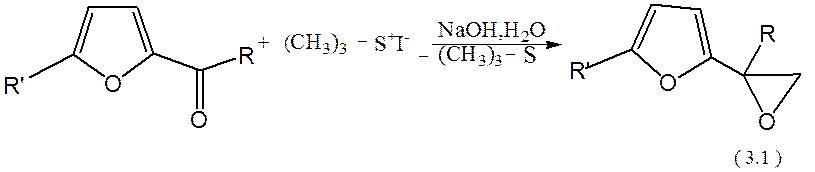
де а. R=R`=H
b. R=H, R`=CH3
c. R=R`=CH3
Ця сполука виявляє певну цікавість, через те що ( 3.1 ) схожий за будовою з ЕФУ, а саме механізм його полімеризації, як за аніонним механізмом, так і за катионною полімеризацію у присутності іонних каталізаторів.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.