Водневі зв’язки між молекулами води і просторові структури молекул, що утворюються, визначають міжмолекулярну структуру води яка слугує однією з причин її аномальних властивостей. Найпростішу структуру має пароподібна вода, яка складається з мономерів, тобто поодиноких молекул води. Щоб перевести воду у пару, необхідно витратити досить багато енергії. При цьому розриваються усі водневі міжмолекулярні зв’язки. Іншу структуру має льод. В ній кожний з атомів кисню молекули води знаходиться у центрі тетраедра, що утворюється чотирма атомами кисню сусідніх молекул. Таким чином, структура льоду являє собою тетраедричну ажурну решітку (рис. 1.3). В процесі розтавання льоду така «льодиста» структура поступово руйнується і поряд з каркасом, що частково зберігся, з’являються невпорядковані молекули води, які можуть заповнити порожнини. При цьому витрачається значно менше енергії ніж при випарюванні води, оскільки руйнуються не всі міжмолекулярні зв’язки (не більше 20 %). Звідки виходить, що у такій воді з температурою близько Оо С головним чином зберігається льодоподібна структура.
Слід зазначити, що існують різні моделі води – модель малих агрегатів молекул води, модель порожнин, змішані моделі різновидів молекули води, модель льодоподібних кластерів, «мерехтливих» кластерів і т. ін. В останні роки велику увагу пригортає модель викривлених водневих зв’язків, у відповідності з якою у рідкій воді, як і у льоді, зберігається тетраедричний порядок у розташуванні молекул.
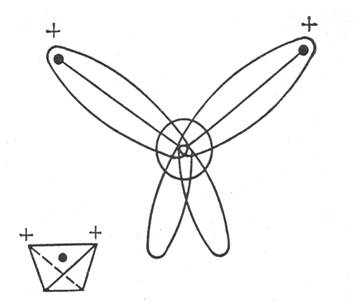
Рисунок 1.1 Електронні орбіта лі і тетраедрична структура молекули води
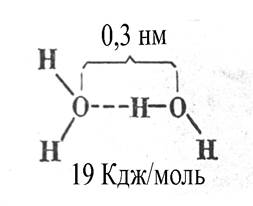
Рисунок 1.2 Схематичне відображення структурних особливостей молекули води і водного зв’язку
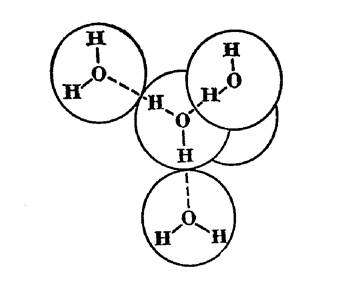
Рисунок 1.3 Тетраедрична гратка льоду
Будовою і особливостями структури молекули води пояснюється її аномальність і унікальність як розчинника. Розчинні речовини змінюють її структуру і властивості, заповнюючи простір всередині кристалічної решітки води. Так, електропровідність розчинів збільшується у десятки тисяч разів, що пояснюється появою у воді безлічі різних за знаком іонів. У солоній воді знижується температура її замерзання: морська вода замерзає при температурі –1,9 оС, а близький до насичення розчин CaCl – при –36 оС.
Існує думка, що кластерна структура води дає змогу накопичувати біоенергію і навіть реагувати на психологічний стан людини. Проте чіткого наукового підтвердження це не має і тому носить форму гіпотези.
1.2. Склад підземних вод
Природні води э складними водними розчинами. У їхньому складі виділяються: макро- і мікрокомпоненти, гази, органічні речовини, мікроорганізми (жива речовина). Велике значення мають ізотопи хімічних елементів як самої води так і розчинних речовин. На сучасну пору у підземних водах різними методами аналізу визначається 85 (зі 105) хімічних елементів таблиці Менделєєва, що характеризують загальний хімічний (геохімічний) тип води та її властивості і мають те або інше наукове та практичне значення.
Природні води за величиною мінералізації поділяються на такі групи: прісні (до 1 г/дм3), солонкуваті (від 1 до 25 г/дм3), солоні (від 25 до 50 г/дм3г/л) і розсоли (більше 50 г/дм3). Слід зазначити, що на практиці часто застосовується величина 35 г/дм3, яка розділяє солоні води і розсоли. Розсоли, у свою чергу, можуть бути дуже слабкими (менше 70 г/дм3), слабкими (70-140 г/дм3), міцними (140-270 г/дм3), дуже міцними (270-350 г/дм3) та надміцними (більше 350 г/дм3).
Розповсюдженість мінеральних речовин у підземних водах є різною, у зв’язку з чим серед них виділяються макро- і мікрокомпоненти.
Макрокомпоненти. Природні води, у своєму кругообігу з різними за складом породами, забирають із них численні хімічні елементи, серед яких переважають Si, C, S, Cl, Са, Na, К, Мg. Вони і є головними комплексоутворювачами в літосфері (99,3 %). Для порівняння вкажемо, що Всесвіт складається приблизно з 76 % водню і 23 % гелію. І лише близько 1 % припадає на всі інші елементи.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.