Легко убедиться, что работа, совершаемая при расширении при постоянном давлении равна:
![]() .
.
Здесь F - сила давления, действующая на элемент поверхности dS, dx - перемещение поверхности. Следовательно dQ= сvdT+pdV. Используя уравнение состояния pυ=RT (υ – удельный объем), можно получить
dQ= (сv+R)dT-υdp=cpdT- υdp,
так как сv+R=cp, или
dQ= cpdT - RT dp/p.
Здесь cp, согласно термодинамике, обозначает теплоемкость при постоянном давлении.
Если изменение состояния газа происходит без обмена теплом с внешней средой, процесс называется адиабатическим. Тогда из предыдущего соотношения получаем
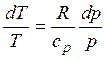
или lnT = R / cp ln p + const. Отсюда
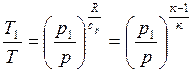 ,
,
где к=сp/cv=(cv+R)/cv – показатель адиабаты. Если подставить Т из уравнения состояния, получим pυк = const. Показатель адиабаты для сухого воздуха[5] к =1.40, (к -1)/ к =0.288.
Изотермический процесс характеризуется постоянством температуры (теплообмен с «резервуаром» настолько эффективен, что температура все время совпадает с температурой «резервуара»): T=const. Тогда из уравнения состояния воздуха получаем pυ = const.
Атмосферные процессы, строго говоря, не являются ни адиабатическими, ни изотермическими, а имеют некоторый промежуточный характер. При движении масс воздуха в той или иной степени происходит теплообмен между ними и окружающей средой. Возможно также нагревание и остывание за счет поглощения и испускания излучения. Все это нарушает условия адиабатичности. Для таких реальных процессов в некоторых случаях справедлива та же формула
pυ к = const,
но ![]() имеет
промежуточные значения между 1.40 и 1. Такие процессы называются политропными,
а параметр
имеет
промежуточные значения между 1.40 и 1. Такие процессы называются политропными,
а параметр ![]() называют показателем политропы[6].
называют показателем политропы[6].
Тем не менее, часто влияние источников тепла и обмен теплом с окружающей средой в атмосфере малы по сравнению с изменением внутренней энергии газа. В таких случаях процессы можно приближенно рассматривать как адиабатические на достаточно коротких временных интервалах, пока не начинают заметно сказываться эффекты обмена теплом.
В термодинамике
понятие «энтропия» было введено немецким физиком Р. Клаузиусом[7]
(1865). Он показал, что процесс превращения теплоты в работу подчиняется второму
началу термодинамики, которое математически формулируется с использованием
понятия энтропии как функции состояния среды (в нашем случае –
воздуха). В соответствии со сказанным, изменение состояния порождает в общем
случае изменение энтропии, а одному и тому же состоянию соответствует одна и та
же энтропия, независимо от способа достижения данного состояния. Согласно
второму началу термодинамики, изменение энтропии системы ![]() связано с теплом
связано с теплом ![]() ,
сообщаемым системе, соотношением
,
сообщаемым системе, соотношением
![]() .
.
Поскольку энтропия является функцией состояния, разность энтропий двух различных состояний системы не зависит от способа, каким осуществлен перевод системы из одного состояния в другое.
Статистическая физика связывает понятие энтропии с вероятностью осуществления данного макроскопического состояния системы (Л. Больцман[8], 1872). Здесь речь идет именно о макроскопическом состоянии, которое характеризуется значениями термодинамических характеристик, а не значениями характеристик всех атомов и молекул, составляющих систему. В свою очередь, совокупность характеристик всех атомов и молекул определяет микроскопическое состояние системы. Если предположить, что все микроскопические состояния равновероятны[9], то согласно теореме о сложении вероятностей, упомянутая выше вероятность реализации данного макроскопического состояния пропорциональна числу различных микроскопических состояний, которые на макроскопическом уровне соответствуют рассматриваемому макроскопическому состоянию.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.