































Удаление электрона со связывающей орбитали уменьшает энергию
связи в молекулярном ионе (N2+, C2+, B2+
и Li2iB), а удаление электрона с разрыхляющей орбитали приводит к
увеличению энергии связи в молекулярном ионе (O2+
и F2+) в сравнении с молекулой.
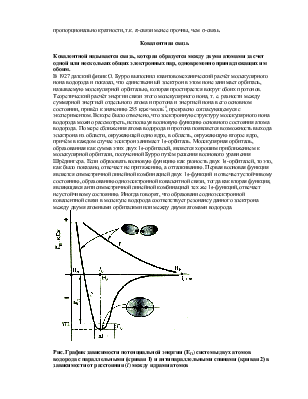
Метод МО позволяет объяснить и магнитные свойства молекул. На диаграмме
энергетических уровней молекулы кислорода и бора имеют по два электрона с
параллельными спинами, значит молекулы в целом имеют отличный от нуля магнитный
момент и являются парамагнитными. Молекулы Li2, C2,
N2, F2 – диамагнитны.
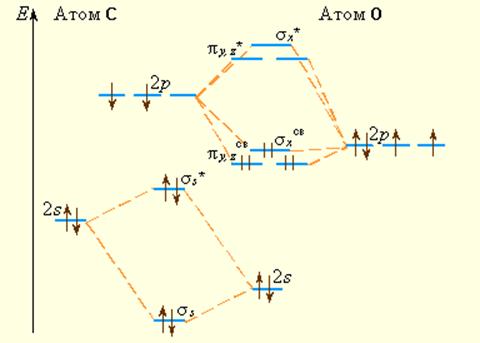
Аналогично можно построить диаграммы уровней энергии МО двухатомных гетерогенных молекул элементов второго периода, например, молекулы СО:
Порядок связи в двухатомных молекулах в методе МО определяется как полуразность количества электронов на связывающих и разрыхляющих МО:
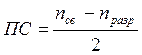 ;
;
Так, порядок связи для молекулы Li2 равна (2 – 0)/2 = 1, Ве – (2 – 2)/2 = 0, В2 – (4 – 2)/2 = 1, С2 – (6 – 2)/2 = 2, N2 – (8 – 2)/2 = 3, O2 – (8 – 4)/2 = 2, F2 – (8 – 6)/2 = 1, Ne2 – (8 – 8)/2 = 0.
Порядок связи в молекулах бериллия (Be2) и неона (Ne2) равен нулю. Действительно, такие молекулы не существуют.
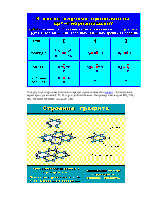
Сравнительная характеристика методов МО и ВС
Оба квантовомеханических подхода к описанию химической связи – методов МО и ВС
– приближенны, метод МО придает преувеличенное значение делокализации электрона
в молекуле и основывается на одноэлектронных волновых функциях – молекулярных
орбиталях. Метод ВС преувеличивает роль локализации электронной плотности и
основывается на том, что элементарная связь осуществляется только парой
электронов между двумя атомами.
Сравнивая методы ВС м МО, следует отметить, что достоинством первого является
его наглядность: насыщаемость связи объясняется как максимальная ковалентность,
направленность вытекает из направленности атомных и гибридных орбиталей;
дипольный момент молекулы складывается из дипольных моментов связей, разности
ОЭО атомов, образующих молекулу, и наличия неподеленных электронных пар. Метод ВС
достаточно хорошо предсказывает валентные возможности атомов и геометрию
образующейся молекулы.
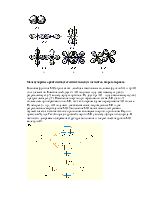
Однако существование некоторых соединений невозможно объяснить с позиций метода
ВС. Это электронодефицитные соединения (B2H6, NO, ) и
соединения благородных газов (XeF2,
XeF4, ХеО3). Их строение легко объясняет метод МО.
Устойчивость молекулярных ионов и атомов в сравнении с молекулами легко
предсказывается с позиции метода МО. И, наконец, магнетизм и окраска вещества
также легко объясняются метода МО.
Количественные расчеты в методе МО, несмотря на свою громоздкость, все же
гораздо проще, чем в методе ВС. Поэтому в настоящее время в квантовой химии метод
ВС почти не применяется. В то же время качественно выводы метода ВС гораздо
нагляднее и шире
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.