

























































фундаментальной естественной науки о законах движения материи к объяснению процессов, происходящих в живой природе.
Целью биофизики является изучение фундаментальных процессов, обеспечивающих основу жизнедеятельности всех без исключения живых организмов, независимо от уровня их развития, эволюционной ступени, возраста индивидуума, среды обитания.
В задачу биофизики входит:
- изучение на молекулярном уровне структуры субклеточных образований и выяснение связей между строением и функциональными свойствами биополиметов и других биологически активных веществ;
- выявление общих закономерностей обмена веществ и энергией на уровне клетки и организма;
- исследование молекулярных механизмов транспорта ионов, молекул через биологические мембраны;
- изучение молекулярных механизмов дыхания, работы механохимических систем;
- исследование поглощения и трансформации энергии в биосистемах;
- термодинамический анализ сложных систем с использованием законов классической термодинамики, а также термодинамики необратимых процессов, теоретическое обоснование термодинамических основ жизни;
- кинетический аналитический подход к изучению сложных систем и предсказание их поведения.
Живые огранизмы – открытая, саморегулирующаяся, самовоспроизводящаяся и развивающаяся гетерогенная система, важнейшими функциональными компонентами которой являются биополимеры: белки и нуклеиновые кислоты сложного атомно-молекулярного строения.
Термодинамические системы, виды термодинамических систем.
Система – совокупность взаимодействующих между собой относительно элементарных структур или процессов, объединяющихся в целое выполнением некоторой общей функции, несводимой к функциям ее компонентов.
Термодинамическая система – часть пространства с материальным содержимым, ограниченная оболочкой.
Область вне оболочки – окружающая среда.
В зависимости от характера взаимодействия с окружающей средой термодинамические системы делятся на три типа:
а) изолированные (не обмениваются с окружающей средой ни веществом, ни энергией);
б) замкнутые (обмениваются только энергией);
в) открытые (обмениваются веществом и энергией). Живые организмы – открытые термодинамические системы.
Параметры термодинамической системы:
- экстенсивные - зависят от количества вещества в системе (масса, объем);
- интенсивные - не зависят от количества вещества в системе (давление, t0).
Количество теплоты, поступающей в систему (dQ),![]() расходуется на
увеличение внутренней энергии системы (dU) и совершение работы против внешних
сил (dA).
расходуется на
увеличение внутренней энергии системы (dU) и совершение работы против внешних
сил (dA).
dQ = dU + dA
В живых организмах совершаются различные виды работ.
Химическая работа – работа, совершаемая при синтезе высокомолекулярных соединений из низкомолекулярных и при осуществлении определенных химических реакций.
Механическая работа – работа по перемещению тел против механических сил.
Осмотическая работа – работа по перемещению различных веществ через мембраны из области низкой концентрации этих веществ в область более высокой концентрации.
Электрическая работа – работа по переносу заряженных частиц (ионов) в электрическом поле, создание разности электрических потенциалов и электрического тока.
Работа – это мера превращения энергии одной формы в другую.
Для доказательства приложимости первого закона термодинамики к биологическим объектам был применен ледяной калориметр. По скорости таяния льда находили теплоту, выделенную лабораторным животным в изолированной камере (ледяном калориметре). Сравнивали с количеством тепла, выделяемом при прямом сжигании до СО2 и Н2О продуктов питания. Были получены величины близких порядков.
Таким образом, было доказано, что живые организмы не являются источником новой энергии и окисление поступающих в живой организм питательных веществ приводит к высвобождению в нем эквивалентного количества энергии.
Второй закон термодинамики
Энтропия (S) – это часть общей энергии клетки, которая не может быть использована в данной системе. Энтропия имеет троякий смысл.
1. Если в термодинамической системе происходят процессы, связанные с выделением или поглощением тепла, то эта система при любой температуре способна поглотить некоторое дополнительное количество тепла. Величина, характеризующая тепловую емкость системы, и является энтропией.
2. Энтропия как термодинамическая функция состояния системы, являющаяся мерой ее неупорядоченности (лед S = 9.8, жидкость S = 16.7, газ S = 45.1)/
3. Энтропия как мера вероятности состояния системы. Это понятие энтропии как величины, пропорциональной логарифму вероятности нахождения системы в конкретном макросостоянии ввёл Больцман.
S = k·lnW, где W – термодинамическая вероятность;
k – постоянная Больцмана.
Термодинамическая вероятность – это количество микросостояний, возможных в пределах данного макросостояния.
Рост энтропии при самопроизвольных процессах означает переход системы, состоящей из большого числа частиц, в наиболее вероятное состояние, т.е. к максимальному числу микросостояний.
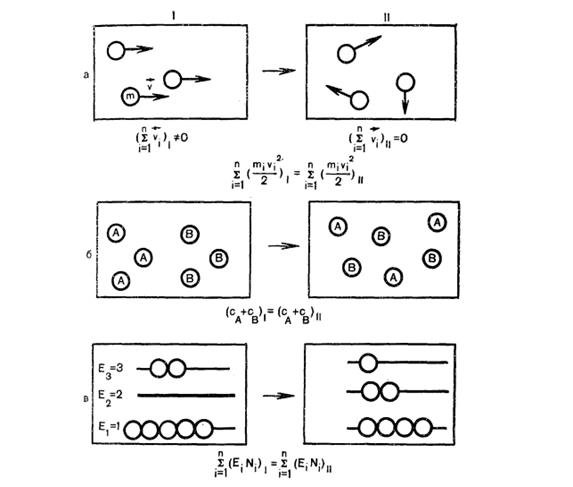
Рис. 1. Примеры перехода систем в наиболее вероятное состояние в направлении I→ II (SII>SI)
а – изменение ориентации частиц (превращение кинетической энергии движущего тела в тепло);
б – изменение распределения частиц в пространстве (диффузия);
в – изменение распределения частиц по энергетическим уровням.
В изолированных системах необратимые термодинамические процессы протекают в направлении возрастания энтропии. Энтропия полностью обратимых термодинамических процессов сохраняет постоянное значение.
Дриллюэн классифицировал виды энергии по их способности превращаться в другие виды энергии.
A. – максимально эффективная, т.е. способна превращается во все другие виды энергии. Это - гравитационная, ядерная, световая, электрическая.
B. – химическая – энергия химической связи.
C. – тепловая. Это особый, самый обесцененный вид энергии, который не может переходить без потери в другие виды энергии. Тепловая энергия связана с хаотическим движением молекул и характеризуется максимальной энтропией, остальные виды энергии базируются на упорядоченном движении молекул.
Деградация высших типов энергии в энергию низших типов – основное эволюционное свойство изолированных систем.
Исходя из того, что живые организмы – системы открытые, изменение энтропии для них складывается из продукции энтропии внутри организма за счет необратимых биохимических процессов (diS) и обмена энтропии с окружающей средой (dеS)
dS = diS + dеS
![]()
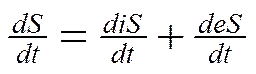 ,
,
где t– время. Это уравнение является математическим выражением второго закона термодинамики для биосистем.
Стационарное состояние (устойчивое и неустойчивое).
Термодинамическое равновесие. Теорема Пригожина.
Принцип Ле-Шателье
Состояние системы, при котором ее параметры не изменяются в течение времени, но происходит обмен веществом и энергией с окружающей средой, называется стационарным.
dS = diS + dеS = 0
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.