Вычисление числа теоретических тарелок.
Определение концентрации.
Более удобное обобщение данных по фазовому равновесию предложено В.С. Кортиковым и В.С. Суриной. При этом концентрацию в паре и жидкости тройной системы азот–аргон–кислород определяют по следующим выражениям:
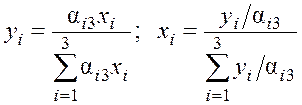 ,
,
где αi3 – относительная летучесть i-го компонента в кислороде.
Для азота
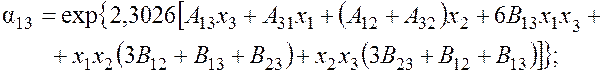
для аргона
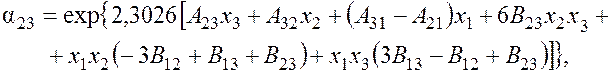
где
A13 = 1,1494 – 0,2696 lgp; A31 = 0,8458 – 0,0673 lgp – 0,0369 lgp2;
A12 = 0,9406 – 0,2194 lgp; A32 = 0,1186 – 0,0347 lgp;
B13 = 0,0518 – 0,015 lgp; B12 = 0,0360 – 0,0102 lgp;
B23 = 0,0046 – 0,0011 lgp; A23 = 0,3938 – 0,0957 lgp;
A21 = 0,4777 + 0,0479 lgp – 0,0432 lgp2; p – давление смеси, кПа.
Свойства разделяемой смеси, наряду с другими параметрами, определяются закономерностью изменения фазового равновесия и коэффициентов разделения соответствующих бинарных систем. Константы фазового равновесия компонентов рассматриваемой тройной смеси азот–аргон–кислород изменяются по нелинейному закону (рис. 4.1).
Наибольшие значения Ki (кривая 1) принадлежат легкокипящему азоту. Вместе с тем константы фазового равновесия компонентов системы азот–аргон–кислород имеют сложную зависимость от давления. Так, если при увеличении давления значения констант K3 и K2 увеличиваются, то K1 уменьшается. В рассмотренном диапазоне изменения концентраций и давлений коэффициенты разделения соответствующих бинарных смесей меняются незначительно. Например, при p = 150 кПа, x2 = 0,10 моль/моль и варьировании x1 от 0,05 до 0,90 моль/моль α12 изменяется от 2,391 до 2,163; α13 – от 3,438 до 3,245; α23 – от 1,438 до 1,500, а при р = 600 кПа при тех же значениях концентрации компонентов α12 изменяется от 1,926 до 1,922; α13 – от 2,348 до 2,563; α23 – от 1,217 до 1,333.
Вычисление относительных летучестей.
В аппаратах узлов низкотемпературной ректификации применяются двухфазные системы, состоящие из жидкой и паровой фаз и включающие два или более компонентов. На контактных устройствах осуществляется соприкосновение жидкой и паровой фаз, и в результате тепло- и массообмена происходит непрерывный обмен веществом между фазами, стремящимися к равновесию.
Для определения условий фазового равновесия рассматривают закрытую систему, в которой осуществляется обмен веществом между фазами. В то же время каждая из фаз представляет собой открытую систему, так как является раствором с переменным составом.
В случае, когда жидкая фаза является идеальным раствором и описывается законом Рауля, парциальное давление компонента в идеальном растворе pi = psi(T) xi, где psi(T) – давление насыщенного пара чистого компонента при температуре раствора Т; xi – молярная доля компонента в жидкой фазе.
При нахождении равновесных концентраций пара или жидкости часто используют константу фазового равновесия
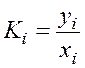 ,
,
где yi – молярная доля компонента в паровой фазе, а также коэффициент разделения
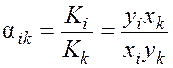 .
.
В частном случае
для идеальных газов и растворов ![]() .
.
Для идеальных растворов с идеальной газовой смесью в паровой фазе при Т = const коэффициент разделения может быть найден из отношения парциальных давлений компонентов:
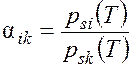 .
.
Значение концентрации i-го компонента в паровой фазе определяют из уравнения
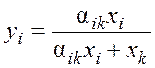 .
.
Температуру насыщения при фазовом переходе в идеальных растворах
по заданному
давлению и составу 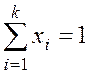 находят из трансцендентного уравнения
находят из трансцендентного уравнения
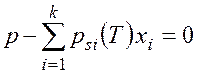 .
.
Если
пар является неидеальной смесью, то для сохранения простой связи между
изотермическими изменениями химического потенциала и мерой способности вещества
переходить из одной системы в другую вводят величину f – летучесть,
или фугитивность. В общем случае летучесть реального вещества является сложной
функцией состояния от температуры и давления. Значение летучести приближается к
величине давления при сближении свойств реального вещества со свойствами
идеального газа, т. е. 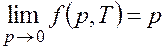 .
.
Отношения
![]() и
и
![]() называют
коэффициентами летучести и парциальной летучести, a fi –
парциальной летучестью.
называют
коэффициентами летучести и парциальной летучести, a fi –
парциальной летучестью.
При
проведении исследований и решении практических задач удобно оперировать
эталонными, или стандартными, состояниями, которые входят в определение
«летучесть». Вводя понятие стандартного состояния (обозначено надстрочным
индексом 0), получают для компонента смеси ![]() . Это так называемая
относительная летучесть, или активность, а величина, получившая название
«коэффициент активности»,
. Это так называемая
относительная летучесть, или активность, а величина, получившая название
«коэффициент активности»,
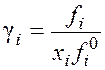
аналогична
коэффициенту летучести, или фугитивности, ![]() .
.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.