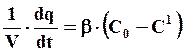 (7.24)
(7.24)
где β – коэффициент массопередачи, пропорциональный D1.
На поверхности происходит химическая реакция первого порядка со скоростью
![]() (7.25)
(7.25)
В стационарном состоянии сколько вещества подводится , стллько и реагирует, т.е.
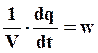 (7.26)
(7.26)
Подставляя (7.24) и (7.25) в (7.26) получим, что концентрация на поверхности (х = 0)
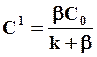 (7.27)
(7.27)
а скорость процесса
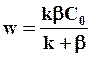 (7.28)
(7.28)
Если медленным является подвод вещества к поверхности х = 0, то в этом случае β << k; С1 << C0, тогда
![]() (7.29)
(7.29)
Следовательно, скорость суммарного процесса определяется коэффициентом массопередачи или коэффициентом внешней диффузии, т.е. процесс контролируется внешней диффузией.
Если медленной является химическая реакция на поверхности х = 0, то в этом случае k << β; С1 ≈ С0, тогда
![]() (7.30)
(7.30)
в этом случае скорость суммарного процесса определяется скоростью химической реакции.
7.7.2. Кинетика удаления и поглощения газа жидким металлом
Реакция перехода атома А из растворенного состояния в металле в двухатомную молекулу в газе можно представить
![]()
Константа равновесия этой реакции
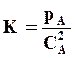 (7.31)
(7.31)
где рА – парциальное давление А2 в газовой фазе; СА2 – концентрация А в растворе.
Температурную зависимость константы равновесия описывает уравнение Вант-Гоффа
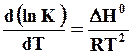 (7.32)
(7.32)
где ΔН0 – стандартное изменение теплосодержания системы, равное тепловому эффекту превращения, взятому с обратным знаком. При растворении газов в металлах тепло поглощается, поэтому ΔН > 0; для реакции перехода атома А из раствора в газ, напротив, ΔН < 0, т.е. тепло выделяется.
Из уравнений (7.31) и (7.32) следует, что с уменьшением СА необходимо уменьшать рА, так как К – величина постоянная при данной температуре. Это можно добиться путем вакуумирования или добавления инертных газов. Кроте того, растворимость газов в металлах растет с температурой, поэтому простым нагревом удалить газ из металла нельзя. В общем случае растворимость подчиняется закону Сивертса: СА ~ рА.
На практике используют различные способы дегазации:
- нагрев или плавление в вакууме;
- нагрев или плавление в инертной или активной среде;
- изменения растворимости при охлаждении и фазовых превращений, вследствие образования избыточной фазы и ее удаления (раскисления) и др.
Процесс дегазации твердого металла является типичным гетерогенным процессом, скорость которого контролируется диффузией вскоре после начала процесса.
При дегазации жидкого металла процесс осложняется тем, что коэффициент диффузии в жидкости гораздо выше, а, кроме того, нельзя пренебрегать конвективным перемешиванием, возникающим в результате перемещения всей массы жидкости.
Плотность потока вещества, подходящего к поверхности в единицу времени, при учете конвективной диффузии будет в общем случае описываться уравнением
![]()
![]() (7.33)
(7.33)
где α – скорость конвективного потока.
Второе уравнение Фика примет в этом случае вид
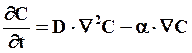 (7.34)
(7.34)
Для расчетов чаще всего пользуются уравнением (7.33), предполагая, что по отношению к потоку молекулярной диффузии устанавливается стационарное состояние в некотором слое у поверхности толщиной Δ, так что
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.