Экспериментальная часть
Цель работы: изучить влияние различных факторов на кинетику и равновесие физико-химических процессов.
1. Зависимость скорости реакции от концентрации реагирующих веществ
2.1. Ход опыта
Проведём реакцию взаимодействия йодата калия (KIO3) с сульфитом натрия (Na2SO4) в присутствии H2SO4 и индикатора на свободный йод – крахмала. Процесс протекает в несколько стадий. Суммарное уравнение реакции:
2KIO3 + 5Na2SO3 + H2SO4 = I2 + 5Na2SO4 + K2SO4 + H2O,
ионный вид уравнения:
2IO-3 + 5SO32-+2H+=I2+5SO42-+H2O.
Йод окрашивается в синий цвет в присутствии крахмала.
Таблица 1
Результаты эксперимента
|
Номер стакана |
Объём, мл |
Относительная концентрация раствора Б (нормальность) |
Время τ,с |
Относительная скорость реакции V=1/τ,с-1 |
|
|
Раствор Б |
Дистил. вода |
||||
|
1 |
10 |
0 |
0,02 |
6 |
0,17 |
|
2 |
10 |
5 |
0,0133 |
10 |
0,1 |
|
3 |
10 |
10 |
0,01 |
14 |
0,071 |
|
4 |
10 |
15 |
0,008 |
17 |
0,059 |
|
5 |
10 |
20 |
0,0066 |
21 |
0,048 |
Проведём 5 измерений при постоянной комнатной температуре и концентрации
KIO3. Данные отражены в таблице.
1.2. Зависимость скорости реакции от концентрации реагирующих веществ
Рассчитаем скорость реакции по формуле Vi = 1/ τi (i = 1..5). Построим график по полученным значениям:
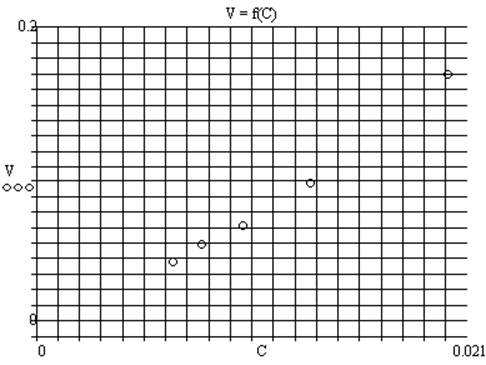
1.3. Вывод
В результате выполнения опыта установлено, что скорость химической реакции выше, когда выше концентрация реагирующих веществ выше. Так как выше число эффективных соударений.
2. Зависимость скорости реакции от температуры
2.1. Ход опыта
Проведём реакцию окисления щавелевой кислоты (H2C2O4) в присутствии H2SO4 перманганатом калия (KmnO4) до диоксида углерода:
5H2C2O4+2 KmnO4+3H2SO4=10CO2+2MnSO4+K2SO4+8H2O
ионный вид уравнения:
5H2C2O4+2MnO-4+6H+=10CO2+2Mn2++8H2O
Поместим в одну пробирку 20 капель раствора H2C2O4, а в другую – 20 капель KmnO4 и 20 капель концентрированной серной кислоты. Охладим полученную смесь до комнатной температуры. Поместим обе пробирки в отверстия крышки химического стакана, заполненного на 2/3 водой 30oC. Через 1,5 - 2 минуты перельем содержимое пробирки с подкисленным перманганатом калия в пробирку со щавелевой кислотой и засечем время до обесцвечивания раствора. Проделаем эти же опыты при температурах воды 40,50,60oС, рассчитаем относительную скорость реакции и занесем данные в таблицу 2.
Таблица 2.
Форма записи результатов эксперимента
|
Номер опыта |
Температура t, oC |
Время от начала реакции до конца, τ,c |
Относительная скорость реакции V=1/τ,c-1 |
|
1 |
30 |
51 |
0,02 |
|
2 |
40 |
17 |
0,059 |
|
3 |
50 |
7 |
0,143 |
|
4 |
60 |
4 |
0,25 |
2.2 Расчет и анализ экспериментальных данных
Рассчитаем скорость реакции по формуле Vi = 1/ τi (i = 1..4). Рассчитаем температурный коэффициент γ для V при температурах 30-40oC, 40-50oC, 50-60oC. Получим γ1 = (V 40 0C / V 30 0C) = 2,95 , γ2 = (V 50 0C / V 40 0C) = 2,42, γ3 = (V 60 0C / V 50 0C) = 1,74. Температурный коэффициент γ определим как среднее значение полученных коэффициентов γ = 2,37. Построим график:
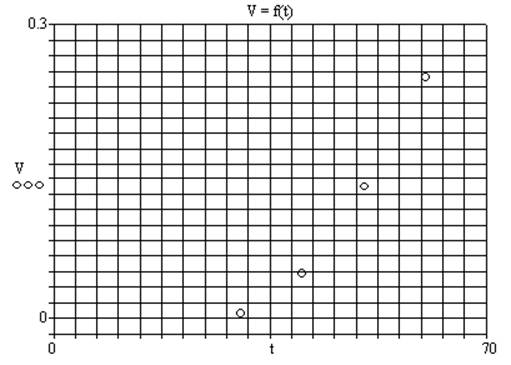
Получается нелинейная зависимость скорости протекания реакции от температуры.
Температурный коэффициент γ зависит от природы реагирующих веществ.
2.3 Вывод
В результате опыта было установлено, что чем больше температура, тем больше скорость реакции. Так как увеличивается количество молекул, обладающих избыточной энергией, - энергией активации, значит увеличивается и число эффективных соударений.
3. Зависимость скорости гетерогенной реакции от величины поверхности реагирующих веществ.
3.1 Ход опыта
Помещаем в две пробирки заполненные на ¼ объема 10% -м раствором соляной кислоты. по 0,5 г мела и мрамора. Уравнение реакции взаимодействия мела или мрамора с соляной кислотой:
CaCO3 + 2HCl = CaCl2 + H2O + CO2
3.2 Расчет и анализ экспериментальных данных.
Реакция с мелом протекла быстрее. Плотность мела меньше, чем плотность мрамора, значит, площадь поверхности взаимодействия будет больше. А так как гетерогенные процессы протекают на границе раздела фаз, то реакция будет более быстрой и более бурной с мелом, чем с мрамором.
3.3 Вывод.
Было установлено, что при большей плотности реагирующих веществ гетерогенные реакции протекают медленнее, так как поверхность взаимодействия будет меньшей, а значит, меньшей будет и вероятность взаимодействия молекул.
4. Влияние концентрации реагирующих веществ на состояние равновесия
4 .1 Ход работы
Смещение химического равновесия будем наблюдать на примере взаимодействия хлорного железа с роданидом калия
FeCl3 + 3KCNS →← Fe(CNS)3 + 3KCl
Смешаем 10 мл FeCl3 и 10 мл KCNS и разольем в 4 пробирки
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.