больше растворимость в ней газов. Растворенный в нефти газ увеличивает объем нефти и уменьшает её плотность, вязкость и поверхностное натяжение. Если объем газа значительно превышает объем нефти, то при давлении более 25 МПа и температуре 95 0С наступает обратная растворимость – жидкие углеводороды растворяются в газе и могут полностью превратиться в газ. При понижении давления из смеси будет выпадать конденсат (жидкие углеводороды).
Миграция нефти через плохо проницаемые породы невозможна, но нефть, растворенная в газе, может мигрировать. Это свойство следует учитывать при прямых и геохимических методах поисков месторождений нефти и газа, а так же при разработке месторождений.
Уравнение состояния газов. Состояние газа характеризуется давлением r, температурой Т, объемом V. Уравнение состояния реальных газов отличается от идеальных, а четкие математические уравнения описывают состояние идеальных газов. Уравнение состояния Ван-дер-Ваальса для реальных газов имеет вид:
(р + а / V2) (V - в) = R Т,
где р – давление, а - сила притяжения молекул, в – объем молекул газа, V –объем газа, Т – температура, R – газовая постоянная.
Однако в промысловом деле имеется смесь газов, что затрудняет применение уравнения. Разработаны другие уравнения для этого случая: Битти – Бриджмена; Бенедикта, Ватта, Рабина. Для практических расчетов пользуются уравнением Клапейрона, учитывающем коэффициент сжимаемости (сверхсжимаемости) реальных газов:
р V = Z m R T ,
где, Z- коэффициент сжимаемости, m – масса.
Реальный газ по свойствам приближается к идеальному при низких давлениях. С повышением давления молекулы газа сближаются, возрастают силы притяжения между ними, и газы сжимаются сильнее, коэффициент сжимаемости уменьшается. С ростом давления свойства газа приближается к свойству жидкости, начинают проявляться взаимоотталкивающие силы между молекулами, и коэффициент сжимаемости вновь возрастает.
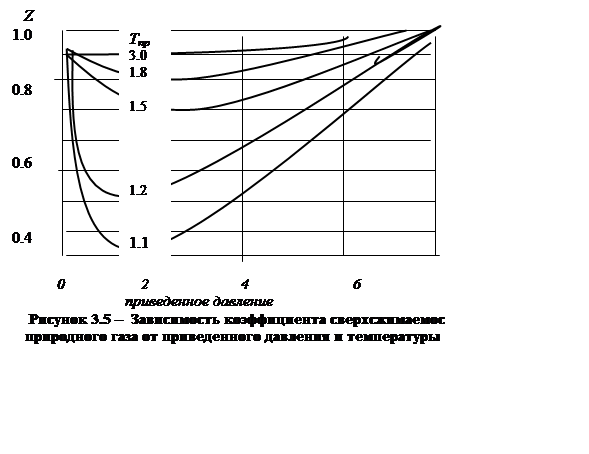
Коэффициент сжимаемости газа – это степень изменения его объема при отличии температуры и давления в долях от критических значений. Термодинамические свойства газов, с равными приведенными температурой и давлением, практически одинаковы, т.к. газы находятся в одинаковом приближении к жидкому состоянию. Графики коэффициента сжимаемости газов в приведенных координатах с практической точностью совпадают и используются для вычисления удельных объемов и других параметров любого газа.
Рпр= р /(Σ уi ркр i ), Тпр = Т / (Σ уi Ткр i),
где р,Т – давление и температура газа, уi - мольная концентрация i-го компонента газа. Рпр , Тпр – выражают давление и температуру в долях от критических величин.
Для идеального газа f = р, для реального g = f /р, где g - коэффициент летучести, р – давление. Приближенно f = Z р.
 |
.
Минимум коэффициента сверхсжимаемости газа обусловлен переходом от силы притяжения между молекулами к силам отталкивания с увеличением давления. При высоких температурах минимум отсутствует, работают силы отталкивания. С увеличением температуры коэффициент сверхсжимаемости газа увеличивается.
С помощью коэффициента сжимаемости определяют объем газа в различных условиях
V = V0 Z (Т / (273 р)) ; V/ V0 = (Z / р) (Т/ 273)
Отклонение законов состояния реальных газов от идеальных учитывают используя функцию давления f – летучесть (фугитивность). Это функция исправленного давления, после учета величины его формулы идеального газа, становится пригодны для определения состояния реального газа (рисунок 3.5)
3.4 СВОЙСТВА ПЛАСТОВЫХ ВОД
Строение молекулы и структурные особенности воды. Масса воды состоит из 11,11% водорода и 88,89% кислорода. Это простейшее химическое соединение одного атома кислорода и двух атомов водорода. Известно три изотопа водорода – протий, дейтерий, тритий и шесть изотопов кислорода. Поэтому в природных условиях выявлено 18 разновидностей молекул воды. Природная вода в основном состоит из молекул 1Н216О, а остальные разновидности присутствуют в ничтожно малых количествах.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.