





















Смещение равновесия подчиняется правилу, названному принципом Ле Шателье: «Если на систему, находящуюся в равновесии, оказывается внешнее воздействие (изменяется концентрация, давление, температура), то равновесие смещается в ту сторону, которая ослабляет данное воздействие». Чтобы сместить равновесие вправо (→), необходимо:
§ понизить температуру (↓),т.к.данная реакция экзотермическая;
§ повысить общее давление (↑),т.к. химическая реакция идет с уменьшением объема (3V → 2V);
§ увеличить концентрацию исходных веществ; уменьшить концентрацию продуктов реакции.
№ 111
Произведите необходимые вычисления и найдите недостающие величины, обозначенные знаком «?» (все растворы - водные).
|
Растворен-ное вещество |
Масса растворен-ного в-ва,г |
Масса раствори-теля,г |
Объем раствора, мл |
Плотность раствора, г/см3 |
Массовая доля, % |
Мольная доля, % |
Молярная концентра-ция, моль/л |
|
HF |
? |
? |
225 |
1,16 |
49 |
? |
? |
|
127,89 |
133,11 |
225 |
1,16 |
49 |
46 |
28,4 |
M (HF) = 1+19 = 20 г/моль M(H2О) = 1∙ 2 +16 = 18 г/моль
m(р-ра) = V∙![]() m(р-ра) = 225 мл ∙ 1,16 г/см3 = 261 г
m(р-ра) = 225 мл ∙ 1,16 г/см3 = 261 г
m(HF) = m(р-ра) ∙ ![]() m(HF) = 261 г ∙ 0,49 = 127, 89 г
m(HF) = 261 г ∙ 0,49 = 127, 89 г
m(р-ля) = m(р-ра) - m(HF) m(р-ля) =261 г - 127, 89 г = 133,11 г
с = ![]() ; n =
; n = ![]() ; n(HF) =
; n(HF) = 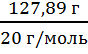 = 6,4; c =
= 6,4; c = 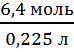 = 28,4 моль/л
= 28,4 моль/л
N = 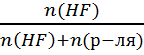 n(H2O)
=
n(H2O)
= 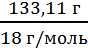 = 7,4 моль
= 7,4 моль
N = 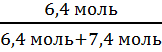 = 0,46 или 46%
= 0,46 или 46%
№ 132
Для реакций, протекающим по приведенным схемам, составьте уравнения методом электронного баланса. Для каждой реакции укажите, какое вещество является окислителем, а какое – восстановителем и за счет каких атомов. Определите типы ОВР.
Na2Se+4O3 + Cl02 + NaOH → Na2Se+6O4 + NaCl- + H2O
![]() Se+4 - 2ē → Se+6
1
Se+4 - 2ē → Se+6
1
Cl02 + 2ē →2Cl- 1
Na2SeO3 + Cl2 + 2NaOH → Na2SeO4 + 2NaCl + H2O
Na2SeO3 – восстановитель; Cl2 – окислитель Реакция межмолекулярная (окислитель и восстановитель находятся в разных веществах)
H2Mn+6O4 → HMn+7O4 + Mn+4O2 + H2O
![]() Mn+6 + 1ē → Mn+7 2
Mn+6 + 1ē → Mn+7 2
Mn+6 - 2ē → Mn+4 1
3H2MnO4 →2HMnO4 + MnO2 + 2H2O
H2MnO4 – окислитель и восстановитель. Реакция диспропорционирования (раньше ее называли реакцией самоокисления - самовосстановления). Исходное вещество образует соединения, одно из которых содержит атомы с более высокой, а другое с более низкой степенью окисления.
№ 157
По заданию из таблицы 7 составьте схему гальванического элемента, напишите электронные уравнения электронных процессов и суммарное уравнение соответствующей ОВР. Вычислите концентрацию раствора электролита (№ 141 - №150) или ЭДС (№151 - №160)
|
Металл 1-го электрода |
Электролит 1-го электрода |
Концентрация электролита 1-го электрода, моль/л |
Металл 2-го электрода |
Электролит 2-го электрода |
Концентрация электролита 2-го электрода, моль/л |
ЭДС,В |
|
Hg |
HgCl2 |
0,01 |
Al |
AlCl3 |
1,00 |
2, 458 |
Схема гальванического элемента
![]()
![]()
![]()
![]() ē
ē
![]()
![]()
![]()
|
Hg2+ 2Cl- HgCl2 |
Al3+ 3Cl- AlCl3 |
При работе гальванического элемента Al-электрод окисляется. Катионы алюминия переходят в раствор. Высвобождающиеся электроны движутся по внешней цепи к Hg-электроду. На нем идет восстановление катионов ртути.
![]() Al0 - 3ē → Al3+
2
Al0 - 3ē → Al3+
2
Hg2+ + 2ē → Hg0 3
Суммарное уравнение:
2Al0 + 3Hg2+ → 2Al3+ + 3Hg0
2Al0 + 3HgCl2 → 2AlCl3+ 3Hg0
ЭДС гальванического элемента рана разности потенциалов двух его электродов.
Решение
E = E0 +![]() lg c
lg c
1. Вычисляем потенциал Al-электрода.
EAl = - 1,662 +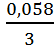 lg 1 = - 1,662 +
0,029 ∙ 0 = - 1,662 в
lg 1 = - 1,662 +
0,029 ∙ 0 = - 1,662 в
2. Вычисляем потенциал Hg –электрода.
EHg = + 0,854 +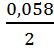 lg 0,01 = +
0,854 + 0,029 ∙ (-2) = 0,796 в
lg 0,01 = +
0,854 + 0,029 ∙ (-2) = 0,796 в
3. Находим ЭДС.
E = 0,796 – (- 1,662) = 2,458 в
№ 175
В соляную кислоту опустили две цинковые пластинки, одна из которых частично помеднена. Как происходит коррозия в том и другом случае? Составьте электронные уравнения анодных и катодных процессов. Какие продукты при этом образуются?
1) Zn-пластинка погружена в раствор HCl.
В кислой среде атомы Zn окисляются ионами водорода (H+) в ионы цинка (Zn+2), которые переходят в раствор.
Zn0 - 2ē → Zn+2
2H++ 2ē → H02↑
Zn0 + 2H+ → Zn+2 + H02↑
В результате этого в кристаллической решетке цинка накапливается избыток электронов, которые затрудняют переход ионов цинка в раствор (коррозия замедляется).
2) Zn-пластинка (частично помеднена) погружена в раствор HCl.
При контакте 2-х металлов (Zn-Cu) с электролитом (HCl) один металл выполняет роль анода (более активный), а другой – катода (менее активный). На аноде (Zn) идет окисление атомов Zn с образованием катионов:
Zn0 - 2ē → Zn+2 (анод)
Поток электронов перемещается к катоду (Cu), где накапливается избыточное количество электронов. Ионы водорода (H+) движутся к катоду, принимают электроны и восстанавливаются.
На катоде (Cu): 2H++ 2ē → H02↑
Суммарное уравнение: Zn0 + 2H+ → Zn+2 + H02↑
Коррозия Zn в контакте с Cu идет быстрее, т.к. свободные электроны цинка постоянно перемещаются к меди и не накапливаются.
№ 187
Как будет происходить электролиз водного раствора электролита (CuCl2) при использовании инертных электродов? Приведите уравнение диссоциации электролита и поясните возможность участия каждого из образующихся ионов в электродных реакциях. Составьте электронные уравнения процессов, протекающих на электродах. Вычислите массу (для твердых и жидких) или объем (при н.у. для газообразных веществ), образующихся на электродах (если на катоде выделяются два вещества, расчет проводить только для металла)
Данные: вещество - CuCl2;время проведения электролиза(τ) – 55 мин.; сила тока (I,A) – 14.
Электролиз раствора CuCl2 на инертных электродах:
CuCl2 → Cu2+ +2Cl-
Процесс на катоде зависит от положения металла (катиона) в электрохимическом ряду напряжения металлов. Катионы меди Cu2+ находятся в ряду напряжений после водорода, они и восстанавливаются на катоде.
На инертном аноде при электролизе солей бескислородных кислот (кроме
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.