Активный центр РНКазы А и структура фермент-субстратного комплекса. В рибонуклеазе имеется четко выраженная расщелина для связывания субстрата, в ней располагаются Lys7, Gln11, His12, Lys41, Thr45, Lys66, His119, Phe120, Ser123 (P0, R1, B1, P1, R2, B2, P2, B3 - места связывания соответственно 5’-фосфатной группы, рибозы, урацила, фосфатной группы, рибозы, аденина, фосфатной группы, аденина тринуклеотида - pUpApA).
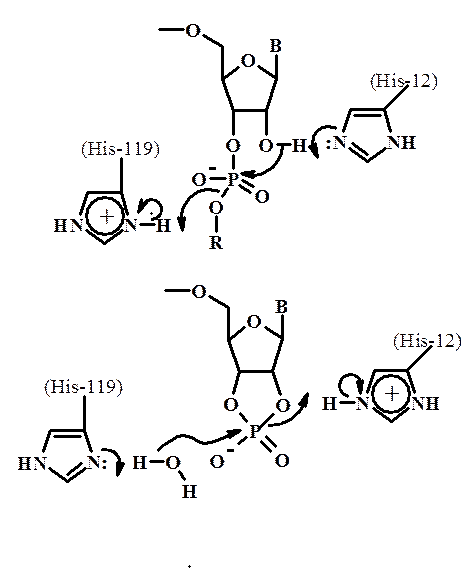
Схема механизма действия РНКазы А
Пиримидиновое основание (на схемах Ura) образует три водородные связи с Ser123 (ОН-гр.) и Thr45 (ОН- и NH-гр.) и находится в стэкинге с ароматическим кольцом Phe120. His119 и Gln11 образуют водородные (Н–Н) связи с кислородами гидролизуемой фосфодиэфирной связи, а His12 с 2’–ОН-группой рибозы пиримидина. Кислороды фосфатных групп Р0, Р1 и Р2, образуют электростатические взаимодействия с Lys66, Lys41 и Lys7, соответственно.
На стадии циклизации His12 выступает в роли общего основного катализатора, а His119 ¾ в роли общей кислоты. Заряженный имидазольный остаток His119 подает протон, необходимый для образования 5'-гидроксигруппы аденозина, а непротонированный His12 отнимает протон от 2'-гидроксигруппы, атакуемой атомом Р (первая реакция схемы).
На стадии гидролиза His12 и His119 меняются ролями; His119 активирует атаку воды по механизму общего основного катализа, а His12 является кислотным катализатором, протонирующим уходящую группу (нижняя реакция схемы).
Сериновые протеазы (ЕС 3.4.21.) являются ферментами, гидролизующими пептидные связи в белках.
Активный центр сериновых протеаз и структура фермент-субстратного комплекса. В протеазах есть «карман», связывающий боковую цепь С-концевой расщепляемой аминокислоты.
Каталитический центр протеаз представлен сериновой триадой – серином, гистидином и аспартатом. В случае химотрипсина - это Ser-195, His-57 и Asp-102.
Химический механизм действия сериновых протеаз как пример нуклеофильного катализа. Механизм действия сериновых протеаз хорошо исследован на примере трипсина, химотрипсина и эластазы, отличающихся лишь специфичностью по отношению к природе карбонильного компонента расщепляемой пептидной связи.
На первой стадии гидролиза пептидов химотрипсином (ЕС 3.4.21.1.) - ацилирования, в результате атаки субстрата гидроксилом Ser195 образуется невалентно связанное промежуточное соединение, превращающееся в тетраэдрическое промежуточное соединение (см. схему ниже). Затем оно распадается с образованием ацилфермента - промежуточного продукта катализа, при этом расщепляется пептидная связь.
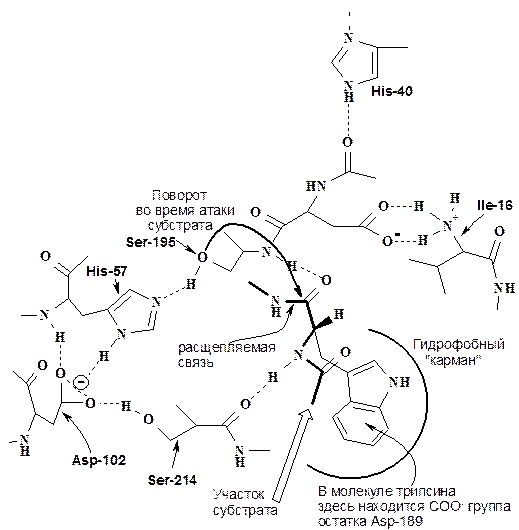
Схема фермент-субстратного комплекса (химотрипсин)
На второй стадии гидролиза пептида - деацилирования, ацилфермент гидролизуется с отщеплением N-концевой части полипептида и одновременной регенерацией в активном центре триады аминокислот.
Каталитическая активность химотрипсина определяется необычайно высокой реакционноспособностью Ser-195. Находящиеся рядом карбоксилат-анион аспартата и имидазольная группа гистидина формируют систему переноса заряда. Эта система играет ключевую роль в катализе, благодаря способности связывать протон и обеспечивает с одной стороны челночную передачу протона, а с другой – повышает нуклеофильный характер остатка серина в активном центре.
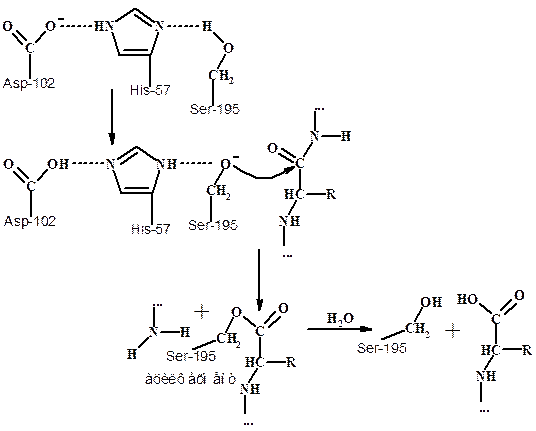
Схема механизма действия сериновых протеаз (химотрипсина)
|
Для осуществления электрофильного или окислительно-восстановительного катализа белковые молекулы фермента сами по себе неактивны и требуют присутствия кофакторов - ионов металлов или сложных органических молекул (простетических групп), белковая часть фермента без кофактора называется апоферментом.
Карбоксипептидаза А (ЕС 3.4.17.1.)– пример фермента, кофактором которого является ион цинка, осуществляющего благодаря последнему электрофильный катализ.
Панкреатическая карбоксипептидаза А – экзопептидаза, гидролизующая С-концевую пептидную связь в полипептидах; она специфична к объемным остаткам гидрофобных аминокислот, содержащим ароматическую или большую алифатическую боковую цепь.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.