

Федеральное государственное образовательное учреждение
высшего профессионального образования
«СИБИРСКИЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ»
____«ИНСТИТУТ ЦВЕТНЫХ МЕТАЛЛОВ И МАТЕРИАЛОВЕДЕНИЯ»___
институт
__________________________________________________________________
кафедра
ОТЧЕТ ПО ЛАБОРАТОРНОЙ РАБОТЕ
__________________________________________________________________
тема
Преподаватель ___________ _____________________
подпись, дата инициалы, фамилия
Студент ____________ ___________ _____________________
код (номер) группы подпись, дата инициалы, фамилия
Красноярск 2010
Цель работы: ознакомиться с назначением восстановительной плавки свинцового агломерата, основными физико-химическими процессами при плавке. Определить в лабораторных условиях извлечение свинца в черновой металл и выход шлака.
Теоретическое введение:
Основным сырьем для производства свинца являются сульфидные полиметаллические руды, содержащие не более 8 - 9 % Pb. Руды подвергают обогащению, в результате получают свинцовые сульфидные концентраты, содержащие 30 - 80 % Pb, 1 - 14 % Zn, до 10 % Си, 2 - 15 % Fe, 9 ~ 15 % S, 2 - 13 % SiО2, до 5 кг/т (Аи + Ag).
Перед восстановительной плавкой свинцовые концентраты подвергают окислительному обжигу с одновременным спеканием, т.к. плавка осуществляется в шахтных печах. Исходным материалом для восстановительной шахтной плавки является агломерат (кусковой обожженный концентрат).
Свинцовый агломерат представлен в основном, оксидами металлов и компонентами пустой породы PbO, nPb·mFe2O3, ZnO, ZnO·Fe2O3, ZnO·SiO2, SiO2, Al2O3, CaO, MgO и т.д., небольшим количеством сульфидов ZnS, Cu2S, FeS, PbS, сульфатами и карбонатами CaSO4, ZnSO4, СаСО3.
Целью восстановительной плавки агломерата является максимальное восстановление свинца до металла, ошлаковывание пустой породы.
В процессе плавки в шихте происходят сложные физико-химические превращения, которые можно свести к процессам восстановления, образования штейна и шлакообразования.
При восстановительной плавке агломерата в печь вместе с агломератом загружают кокс.
Состав газовой фазы в шахтной печи формируется в результате горения кокса в области фурм по реакции: С + О2 = СО2 + 393,5 кДж,
и взаимодействия диоксида углерода (СО2) в составе печных газов, нагретых до 1400 - 1500°С с раскаленным коксом: СО2 + С = 2СО - 172.4 кДж.
Для восстановления различных оксидов металлов необходимы различные концентрации оксида углерода и температуры, т.к. каждый металл обладает определенной силой связи (сродством) с кислородом. Чем больше это сродство, тем труднее восстановите данный оксид. Сила связи металла с кислородом, т.е. прочность оксида, выражается через давление диссоциации оксида при разных температурах.
При восстановительной плавке агломерата может происходить восстановление оксидов металлов твердым углеродом по реакции:
МеО + С = Me + СО.
Эта реакция требует тесного контакта между реагирующими веществами.
Основным восстановителем при плавке свинцового агломерата является оксид углерода (СО). Основная реакция плавки МеО + СО = Me + СО2 обратима. В зависимости от условий, в которых протекает реакция, может происходить либо восстановление оксида металла оксидом углерода (СО), либо окисление металла, диоксидом углерода (СО2).
На рисунке приведены кривые равновесных концентраций СО2/СО для реакций восстановления оксидов различных металлов в зависимости от температуры и кривые равновесных концентраций СО2 и СО для реакции:
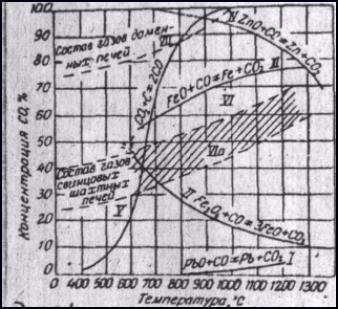 |
Рис.1. Кривые равновесия восстановления оксидов металлов.
Для восстановления оксидов свинца до металла, как видно из диаграммы равновесных кривых (рис.1), требуется слабовосстановительная атмосфера. В этих условиях восстанавливаются также оксиды меди, мышьяка, сурьмы, олова. Восстановленные металлы растворяются в свинце. Высшие оксиды железа Fe2O3 восстанавливаются до FeO. Дальнейшее восстановление до свободного железа требует сильновосстановительной атмосферы. Таким же трудновосстановимым является оксид цинка. В условиях свинцовой плавки, когда в печах газа содержится не более 30 % СО, оксиды цинка, железа переходят в шлак.
Если плавку провести при слабовосстановительной атмосфере и умеренной температуре, то только свинцовые соединения восстанавливаются до металлического свинца, в котором растворяются благородные металлы, медь, мышьяк, сурьма, олово, превращая свинец в черновой металл. Оксиды других металлов, совсем не восстанавливаются: CaO, MgO, Аl2O3, SiO2, частично восстанавливаются Fe2O3 до FeO. Все невосстановленные оксиды образуют шлак. В результате плавки получают два основных продукта: черновой свинец и шлак. Они имеют ограниченную взаимную растворимость и разную плотность благодаря чему их можно легко разделить.
Если в агломерате осталось много серы (после обжига), то при плавке образуется сплав сульфидов (Cu2S, FeS, PbS) - штейн.
Восстановление оксида свинца, входящего в состав сложных соединений (силикатов, ферритов) требует дополнительной затраты энергии на диссоциацию сложных соединений и поэтому протекает при более восстановительной атмосфере и более высокой температуре, чем свободный оксид свинца.
Состав шлака предопределяет его свойства: температуру плавления, вязкость, плотность. Основные свойства шлака свинцовой плавки целесообразно иметь следующими: температуру плавления 1100 - 1150°С; вязкость при 1200°С - 0,5 Па·с; объемную массу не более - 3,8 г/см3. Шлаки с такими свойствами должны содержать основные компоненты в следующих пределах, %: 20 – 30 SiO2; 10-16 СаО; не более 25 ZnO.
Ход работы:
1. Берем навеску свинцового агломерата. Его состав: 50% PbO, 2% CuO,
3% Fe2O3, масса – 10 г. В 10 г агломерата 8 г свинца.
2. Рассчитываем необходимое количество восстановителя (древесный уголь):
Pb - 207 г/моль; О2 - 16 г/моль; С - 12 г/моль;
X1 = (10*685)/621 = 11,03 г. (m Pb3 O4);
X2 = 480/621=0,8 г. (mC);
3. Готовим 2 смеси свинцового агломерата с теоретическим количеством углерода(mC=0,8г и mC=1 г) и тщательно перевешиваем в фарфоровой ступке.
4. Приготовленную шихту высыпаем в шамотный тигель.
5. Шамотный тигель ставим в электрическую печь при t = 1000° С. Выдерживают в печи в течение 30 мин.
6. Тигель из печи вынимаем, и расплав выливаем в изложницы.
7. После охлаждения отделяют металл от шлака и взвешиваем раздельно два состава.
7.1 Pb – 8,7 г.
Рассчитываем:
извлечение свинца
ηPb = [mPb/(Mагл·aPb)]·100% = [8,7/(11·0,92)] · 100% = 85 %;
выход шлака
Wшл = (mшл·Мшл)·100% = 0 %.
8.2 Pb – 6,5 г.
Рассчитываем:
- извлечение свинца
ηPb = [mPb/(Mагл·aPb)]·100% = [6,5/(11·0,92)] · 100% = 64 %;
Вывод: При увеличении количества углерода в плавке увеличивается извлечение свинца.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.